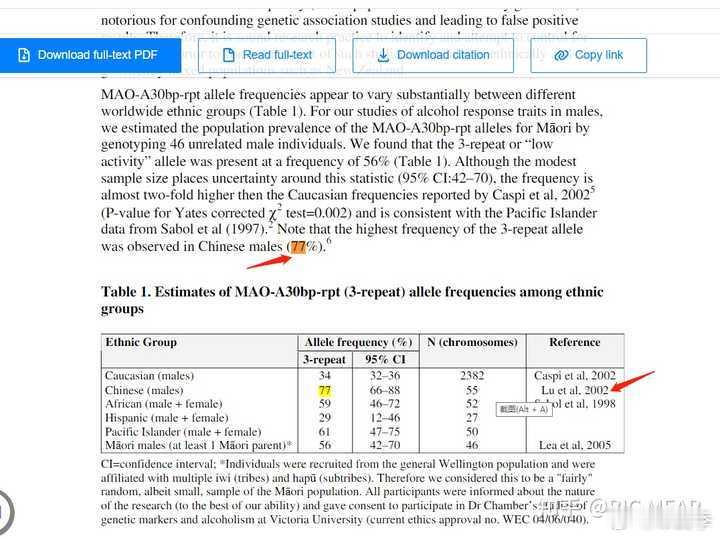
FDA 批准拉泽替尼(Lazcluze)与amivantamab-vmjw(Rybrevant)联合用于治疗EGFR外显子 19 缺失或外显子 21 L858R 替代突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者的一线治疗。该批准得到了第 3 期 MARIPOSA 试验的结果支持。
该组合疗法已成为首个也是唯一一个多靶点、无化疗组合疗法,且在EGFR突变 NSCLC一线治疗中显示出优于奥希替尼 (Tagrisso) 。Rybrevant一种针对 EGFR 和 MET的双特异性抗体,可与免疫系统结合,而 LAZCLUZE是一种高选择性、可穿透大脑的第三代口服 EGFR TKI,可靶向 T790M 突变和激活性 EGFR 突变,同时保留野生型 EGFR。
MARIPOSA 是一项随机、阳性对照、多中心试验,纳入了 1074 名外显子 19 缺失或外显子 21 L858R 替代突变阳性的局部晚期或转移性 NSCLC 患者,且之前未接受过晚期疾病的全身治疗,试验评估了疗效。患者随机(2:2:1)接受拉泽替尼联合阿米凡他单抗、奥希替尼单药治疗或拉泽替尼单药治疗(一种未经批准的 NSCLC 治疗方案),直至病情进展或出现不可接受的毒性。

拉泽替尼的推荐剂量为每日一次口服 240mg,与Rybrevant联合使用,可与食物同时或单独服用。

联合治疗方案显著改善了 PFS(主要终点),风险比为 0.70(95% CI,0.58-0.85;P = .0002)。联合治疗的中位 PFS 为 23.7 个月(95% CI,19.1-27.7),奥希替尼为 16.6 个月(95% CI,14.8-18.5)。在当前分析时,总体生存数据尚不成熟,但未观察到不利趋势。
关于安全性,至少 20% 的患者发生的常见不良事件是皮疹、指甲毒性、Rybrevant输注相关反应、肌肉骨骼疼痛、水肿、口腔炎、静脉血栓栓塞事件 (VTE)、感觉异常、疲劳、腹泻、便秘、 COVID-19 感染、出血、皮肤干燥、食欲下降、瘙痒、恶心和眼部毒性。已注意到与拉泽替尼相关的 VTE 严重安全信号,患者应在治疗的前 4 个月接受预防性抗凝治疗。
MARIPOSA 研究显示,Rybrevant联合拉泽替尼的独特组合在某些EGFR突变晚期 NSCLC患者的一线治疗中表现出优异的疗效。患者现在可以选择一种潜在的新一线标准治疗,其临床益处显著优于奥希替尼。这种一线治疗采用有针对性的治疗方法,旨在实现最佳的患者治疗效果,同时当耐药性变得更加复杂时,将化疗留到治疗后期。
此次批准是 RYBREVANT今年的第二个新适应症,此前,美国 FDA 于 2024 年 3 月 1 日批准RYBREVANT与化疗(卡铂-培美曲塞)联合用于一线治疗 EGFR 外显子 20 插入突变的局部晚期或转移性 NSCLC 患者。