【CMT&CHTV 文献精粹】
导语:晚期实体瘤的治疗面临诸多挑战,尤其是免疫检查点抑制剂和靶向治疗药物的耐药性问题。CD137(4-1BB)作为共刺激分子,对T细胞的激活和扩增具有重要作用。Urelumab是一种针对CD137受体的激动型单克隆抗体,通过提供T细胞强烈共刺激信号,增强对肿瘤的免疫应答。但关于Urelumab的最佳剂量、疗效及安全性,尤其是在与其他免疫治疗药物联合使用时的效果,仍需进一步研究。
2024年1月,国际知名期刊Journal for ImmunoTherapy of Cancer发表了题为“Final results of urelumab, an anti- CD137 agonist monoclonal antibody, in combination with cetuximab or nivolumab in patients with advanced solid tumors”一文,深入探讨了Urelumab与Cetuximab或Nivolumab联合治疗晚期实体瘤患者的两项临床研究,旨在评估这一新型联合疗法的安全性、耐受性及初步疗效。

这两项研究采用了严谨的临床试验设计,以评估Urelumab(一种针对CD137的激动型单克隆抗体)与Cetuximab或Nivolumab联合治疗晚期实体瘤患者的安全性、耐受性、药代动力学、药效学和初步疗效。
CA186-018研究设计:
研究类型:开放标签、多中心、剂量评估和队列扩展的1b期研究。
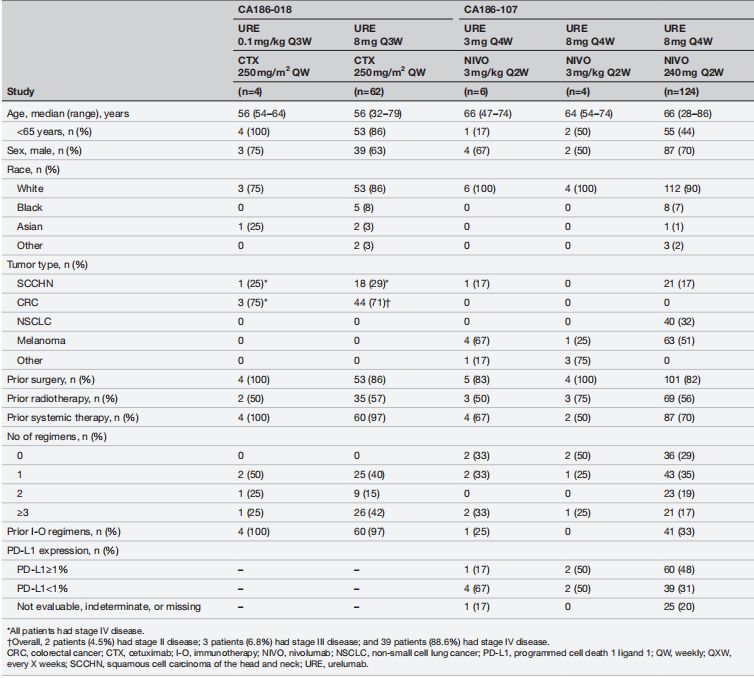
患者筛选:纳入年龄≥18岁,具有晚期/转移性结直肠癌(CRC)或头颈部鳞状细胞癌(SCCHN)的患者。患者需对伊立替康和奥沙利铂方案不耐受或已进展,且ECOG PS ≤1,预期寿命≥3个月。
分组与干预措施:研究分为两个阶段。在剂量评估阶段,患者接受Urelumab 0.1 mg/kg每3周一次,联合每周Cetuximab 250 mg/m2。在剂量扩展阶段,患者接受Urelumab 8 mg固定剂量每3周一次,联合相同剂量的Cetuximab。
CA186-107研究设计:
研究类型:开放标签、多中心、剂量递增和队列扩展的1/2期研究。
患者筛选:纳入年龄≥18岁的成年人,曾接受过晚期或转移性实体瘤的治疗,包括黑色素瘤、非小细胞肺癌(NSCLC)或SCCHN。关键排除标准包括已知的中枢神经系统转移。
分组与干预措施:剂量递增阶段,患者接受Urelumab 3 mg或8 mg每4周一次,联合Nivolumab 3 mg/kg或240 mg每2周一次。剂量扩展阶段,患者接受Urelumab 8 mg每4周一次联合Nivolumab 240 mg每2周一次,治疗周期最长为48周。
共同的研究终点和评估:
主要终点:安全性和耐受性,通过不良事件(AEs)、严重不良事件(SAEs)和治疗相关不良事件(TRAEs)的发生率来衡量。
次要终点:包括客观缓解(ORR)、缓解持续时间(DOR)、无进展生存期(PFS)以及药代动力学(PK)、免疫原性和药效学/生物标志物评估。
研究结果安全性和耐受性评估
在CA186-018研究中,66名患者接受了Urelumab联合Cetuximab的治疗。研究观察到的治疗相关不良事件(TRAEs)中,最常见的是疲劳(75%),尤其是在接受Urelumab 0.1 mg/kg剂量的患者中。此外,使用Urelumab 8 mg剂量联合Cetuximab治疗的患者中,有45%出现了皮炎。在该研究中,有5%的患者因TRAEs中断治疗。CA186-107研究中,134名患者接受了Urelumab联合Nivolumab的治疗,其中32%的患者报告了疲劳,是最常见的TRAE。在该研究中,7%的患者因TRAEs中断治疗,包括1例因严重TRAE中断治疗的黑色素瘤患者。

疗效评估
在CA186-018研究中,尽管没有患者在CRC队列中观察到确定的客观缓解,但有36.2%的患者实现了病情稳定(SD)。在SCCHN队列中,1名患者(5.3%)实现了部分缓解(PR),且在研究结束时仍在持续。在CA186-107研究中,特别是在PD-1未经历治疗的黑色素瘤患者中,Urelumab 8 mg联合Nivolumab 240 mg方案显示出49%的客观缓解率(ORR),其中包括6例完全缓解(CR)和15例部分缓解(PR),中位缓解持续时间(DOR)为21.2个月。

药代动力学和免疫原性
药代动力学(PK)参数在不同剂量的Urelumab治疗中显示出可比性,无论是0.1 mg/kg还是8 mg固定剂量。在接受Urelumab 8 mg治疗的患者中,有47%在治疗后检测到针对Urelumab的抗药物抗体(ADAs),其中26%的患者ADAs具有中和作用。
药效学和生物标志物
治疗后,与免疫和炎症过程相关的基因表达在肿瘤中上调,包括CD3、CD8、CXCL9和GZMB,这表明Urelumab联合Nivolumab可能增强了肿瘤微环境中的免疫细胞活性。此外,与黑色素细胞发育和色素沉着相关的基因在治疗中下调,这可能与治疗后肿瘤微环境中黑色素细胞比例的减少有关。
总结讨论尽管Urelumab在临床试验中表现出了一定的安全性和耐受性,但其与Cetuximab或Nivolumab的联合治疗在提高晚期实体瘤患者生存质量和延长生存期方面并未显示出显著的附加效益。然而,对于未接受过抗PD-1治疗的黑色素瘤患者,Urelumab联合Nivolumab治疗的高缓解率提示,针对CD137的激动剂仍有进一步研究的价值。未来的研究需要探索更优的剂量方案、患者筛选标准以及可能的生物标志物,以期最大化Urelumab的治疗潜力。
参考文献:
Khushalani NI, Ott PA, Ferris RL, et al. Final results of urelumab, an anti-CD137 agonist monoclonal antibody, in combination with cetuximab or nivolumab in patients with advanced solid tumors[J]. J Immunother Cancer. 2024;12(3):e007364. Published 2024 Mar 7. doi:10.1136/jitc-2023-007364
“医学论坛网”发布医学领域研究成果和解读,供专业人员科研参考,不作为诊疗标准,使用需根据具体情况评估。
编辑:连翘
二审:石头
三审:清扬
排版:半夏