本文来源:选自《中华内科杂志》, 2023,62(12) : 1394-1405.
摘要: 糖尿病肾脏病(DKD)是糖尿病主要慢性并发症之一,疾病负担沉重。自《国家基层糖尿病防治管理指南(2018)》发布以来,随着基层基本公共卫生服务和医疗能力的不断提升、工作内容的不断拓展,基层糖尿病防治管理工作需要细化的技术指南。本指南旨在推动基层DKD防治工作规范化,帮助基层医生开展DKD的预防和控制,并对DKD患者进行综合管理。主要内容包括管理基本要求、DKD概述、筛查、诊断与临床分期、治疗、患者随访及转诊。
本指南适用于≥18岁的T2DM。
糖尿病肾脏病概述
慢性肾脏病(chronic kidney disease,CKD)是由各种原因引起的慢性肾脏结构和功能障碍的总称。糖尿病所致的肾脏损害称为DKD,其属于CKD的范畴。DKD主要包括UACR≥30 mg/g 和/或估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)<60 ml·min⁻1·1.73 m⁻2,且持续超过3个月。DKD是由慢性高血糖所致的肾损害,病变可累及全肾(包括肾小球、肾小管、肾间质及肾血管等),临床上以持续性白蛋白尿和/或eGFR进行性下降为主要特征,可进展为终末期肾病(end stage renal disease,ESRD)。
糖尿病肾脏病筛查、诊断与临床分期
一、筛查
推荐T2DM患者在确诊糖尿病时筛查DKD,且以后每年至少筛查1次。筛查项目包括尿常规、UACR和血清肌酐(计算eGFR)。
二、诊断
DKD通常是根据UACR增高和/或eGFR下降,同时排除其他原因所导致的CKD而做出的临床诊断。
推荐采用随机尿测定UACR。UACR≥30 mg/g定义为白蛋白尿,但仅单次UACR增高不能诊断为白蛋白尿,需在3~6个月内重复检测,3次中有2次UACR≥30 mg/g、排除感染等因素后方可诊断白蛋白尿。通常将UACR 30~300 mg/g称为微量白蛋白尿,UACR>300 mg/g称为大量白蛋白尿。诊断糖尿病白蛋白尿还需要排除其他的影响因素,如感染、发热、24 h内运动、心力衰竭、女性月经期等均可能使UACR升高,结果分析时应考虑这些因素。若检测24 h尿白蛋白定量,其诊断价值与UACR相当。
推荐检测血清肌酐水平,并采用CKD-EPI公式计算eGFR(附录4)。当糖尿病患者eGFR<60 ml·min-1·1.73 m-2可诊断为eGFR下降。
当糖尿病患者UACR≥30 mg/g和/或eGFR<60 ml·min-1·1.73 m-2持续超过3个月,并排除其他原因所致的CKD时,临床可以诊断为DKD。
在临床诊断DKD时需要注意:(1)明确糖尿病与慢性肾脏病之间的因果关系:应综合考虑糖尿病病程、血糖控制情况、肾功能下降程度与速度以及是否合并其他微血管并发症等。典型的DKD临床表现包括:病程较长的糖尿病、合并视网膜病变、出现白蛋白尿而无血尿,以及eGFR逐渐下降等。(2)关注UACR正常但eGFR下降,即正常白蛋白尿糖尿病肾脏病(normoalbuminuric diabetic kidney disease,NADKD)的患者。NADKD在高龄、女性及血糖控制良好的人群中较常见。(3)糖尿病视网膜病变(diabetic retinopathy,DR)是诊断DKD的重要依据之一。DR进展与肾脏病理改变及ESRD进展程度相关,DKD患者常常合并DR。
在诊断DKD时需排除其他病因所致的慢性肾脏病。当糖尿病患者伴有肾脏损害并出现以下任一情况时,需考虑非糖尿病肾脏病(nondiabetic kidney disease,NDKD)或DKD合并NDKD,并及时转诊至上级医院明确病因:(1)出现活动性尿沉渣(红细胞、白细胞、细胞管型等);(2)eGFR迅速下降;(3)UACR迅速增高或出现肾病综合征;(4)给予血管紧张素转化酶抑制剂(angiotensin- converting enzyme inhibitors,ACEI)或血管紧张素受体拮抗剂(angiotensin receptor blocker,ARB)治疗后3个月内eGFR下降大于30%;(5)肾脏超声检查发现异常;(6)顽固性高血压;(7)合并其他系统性疾病的症状或体征等。
上述DKD的诊断及鉴别诊断是依据临床表现及实验室检查而做出的临床诊断,糖尿病合并肾损害的病因难以鉴别时,可行肾穿刺病理检查。
三、临床分期
确诊DKD后,应联合CKD分期(G1~G5)和白蛋白尿分期(A1~A3)判定DKD严重程度、进展和死亡风险及临床随访和转诊频率(表1)。例如,某DKD患者的eGFR为40 ml·min-1·1.73 m-2、UACR为358 mg/g,诊断为DKD G3bA3,对应的DKD进展风险为极高风险,应每年至少随访3次。
表1 根据eGFR和UACR分类的CKD进展风险及临床随访和转诊频率

注:eGFR为估算的肾小球滤过率;UACR为尿白蛋白/肌酐比值;CKD为慢性肾脏病;背景颜色代表CKD进展和死亡的风险,表格中的数字为建议每年随访的次数:绿色为低风险,建议每年随访1次;黄色为中风险,建议每年随访1次;橙色为高风险,建议每年随访2次;红色和深红色为极高风险,红色建议每年随访3次,深红色建议每年随访4次及以上;“如有CKD”表示虽无白蛋白尿,但可能存在其他肾脏损伤如病理、尿液、血液或影像学检查异常;a为转诊至肾脏专科随访的频率
糖尿病肾脏病治疗
一、治疗目标
DKD的治疗重在早期干预,综合管理,以减少蛋白尿,延缓eGFR下降,改善肾脏不良结局(如ESRD、肾脏相关死亡等)。科学、合理的治疗策略包括生活方式干预,血糖、血压、血脂和体重的控制(表2)。

DKD患者的血糖控制应遵循个体化原则,根据患者年龄、病程、预期寿命、合并症、并发症、低血糖风险等,制定个体化控制目标(图1)。

注:CKD为慢性肾脏病;G1期为eGFR≥90 ml·min -1·1.73 m -2,G5期为eGFR<15 ml·min -1·1.73 m -2;大多数成年DKD患者HbA 1c控制目标为7%,对于年龄轻、病程短、预期寿命长、低血糖风险小、无或合并轻度并发症、合并症少的DKD患者HbA 1c控制目标可进一步严格至<6.5%,其前提是无低血糖等不良反应;年龄大、病程长、预期寿命短、低血糖风险大、并发症严重、合并症多的DKD患者HbA 1c控制目标可放宽至8%
▲图1 糖尿病肾脏病(DKD)患者糖化血红蛋白(HbA1c)分层控制目标
DKD患者血压控制目标在130/80 mmHg(1 mmHg=0.133 kPa)以下,舒张压不宜低于60 mmHg,并应根据并发症及耐受情况设定个体化的血压目标。
DKD患者的调脂和体重管理综合控制目标同一般T2DM患者。
二、生活方式干预
(一)营养干预
1.总体原则:合理控制总热量,达到或维持理想体重。合理选择搭配食物,尽量做到营养均衡,食物多样,满足患者对各种营养素的需求。适当增加蔬菜和低血糖生成指数(glycemic index,GI)水果的摄入,选择蛋类、奶类、水产类、禽畜类以及大豆及其制品等富含优质蛋白的食物,减少精制碳水化合物(如白米饭、面食等)及含糖饮料和加工肉类的摄入。eGFR<60 ml·min-1·1.73 m-2同时合并UACR≥30 mg/g或者eGFR<45 ml·min-1·1.73 m-2的患者尽量选用优质蛋白来源的食物。提倡选择低GI的食物/品。选择小份食物有助于增加食物种类。平均每天摄入食物种类数在12种以上,每周在25种以上。推荐营养摄入见表3。

2.蛋白质摄入:对于未进行透析治疗的DKD患者,推荐的蛋白质摄入量为0.8 g·kg-1·d-1,优质蛋白的比例应占50%以上;而透析患者常存在营养不良,可适当增加蛋白质摄入量至1.0~1.2 g·kg-1·d-1。优质蛋白来源的食物包括:鸡蛋、牛奶、鱼肉、虾肉、鸡肉、鸭肉、瘦牛肉、瘦羊肉、瘦猪肉、大豆等。
3.脂肪摄入:脂肪摄入需满足人体对必需脂肪酸的需求,同时适当提高ω-3脂肪酸(如鱼油等)的比例,有助于改善血脂代谢异常。
4.钠、钾摄入:每日的钠摄入量应低于2 g(相当于5 g食盐)。高钠和低钠饮食均可能增加高血压、ESRD、心血管疾病(cardiovascular disease,CVD)及死亡风险。严重的DKD患者会出现血钾失衡,高钾血症(血钾>5.5 mmol/L)及低钾血症(血钾<3.5 mmol/L)均会诱发心血管事件。对于合并高钾/低钾血症的DKD患者,应调控富含钾的食材的摄入(表4)。

(二)运动干预
适量规律运动有助于糖尿病患者的血糖、血压和血脂控制,改善心、肺、肾以及认知功能,因此适当强度的运动可延缓DKD进展,同时减少DKD患者的CVD及死亡风险。
1.运动原则:运动目标应综合考虑患者的年龄、心血管合并症、基础运动水平、防跌倒能力等因素。运动可以从低强度、小运动量开始,并定期监测肾功能、电解质及尿蛋白等。
2.运动频率:推荐每周进行150 min的中等强度运动,推荐每周至少活动3 d,连续不运动的天数不超过2 d(如每周5次、每次30 min)。根据患者的具体情况制定目标心率(target heart rate,THR),计算公式见附录5。
3.运动类型:包括有氧运动、抗阻运动以及柔韧性训练等。有氧运动包括健步走、乒乓球、太极拳、羽毛球、骑车和游泳等。常见的抗阻运动项目则包括仰卧起坐、俯卧撑、抬举哑铃、拉伸拉力器等。柔韧性训练(如伸展、拉伸等)在运动的准备阶段和结束阶段进行,多与有氧运动相结合。
4.运动禁忌:如有下列情况应禁止运动训练:糖尿病酮症酸中毒;空腹血糖>16.7 mmol/L或血糖<3.9 mmol/L;糖尿病合并增殖性视网膜病变,严重的肾脏病,严重的心脑血管疾病(不稳定性心绞痛、严重心律失常、短暂性脑缺血发作);糖尿病合并急性感染等。
(三)体重管理
超重和肥胖可增加糖尿病患者的肾脏病风险,有效的体重管理是预防和治疗DKD的重要辅助手段。超重为体重指数(body mass index,BMI)介于24~<28 kg/m2,肥胖为BMI≥28 kg/m2。BMI计算公式为:BMI=体重(kg)÷身高2(m2)。建议超重和肥胖患者短期减重的目标是3~6个月减轻体重的5%~10%;长期(如1年)减重的目标为BMI达到或接近24 kg/m2,或体重至少下降7%,并使体重长期维持在健康水平。超重或肥胖DKD患者的体重管理措施包括生活方式干预、药物治疗及代谢手术等。
(四)戒烟戒酒
吸烟、饮酒是DKD进展的重要危险因素。DKD患者需做到戒烟戒酒,规律作息,配合诊治。
三、降糖治疗
(一)药物治疗原则
基层医疗机构应根据患者的具体病情制定治疗方案,并指导患者使用药物,同时充分评估患者心肾功能、并发症、合并症情况,根据eGFR调整药物剂量;尽量避免使用低血糖风险较高的口服降糖药物。不同肾功能分期降糖药物的使用见附录6。各类降糖药物综合获益、风险评估表见附录7。建议优先选择具有肾脏获益证据的药物。
(二)具有肾脏获益证据的降糖药物
1.钠-葡萄糖共转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitor,SGLT2i):SGLT2i通过抑制肾脏对葡萄糖的重吸收,促进尿糖排出,从而降低血糖。除此之外,部分SGLT2i还有降低白蛋白尿、延缓肾功能下降、并具有心血管保护作用。推荐在eGFR≥45 ml·min-1·1.73 m-2的DKD患者中使用SGLT2i。近期研究结果表明,部分SGLT2i可以在eGFR≥20 ml·min-1·1.73 m-2时使用。具体药物适应证和禁忌证见药品说明书。
SGLT2i的常见不良反应为泌尿系统和生殖系统感染及血容量不足(如症状性低血压、头晕、脱水)等,建议适当补水。同时应关注严重不良反应,如酮症酸中毒。
2.胰高糖素样肽-1受体激动剂(glucagon like peptide-1 receptor agonist,GLP-1RA):GLP-1RA通过激活胰高糖素样肽-1受体促进胰岛素分泌、抑制胰高糖素分泌,从而降低血糖,并具延缓胃排空、抑制食欲等作用。部分GLP-1RA具有肾脏保护作用。GLP-1RA不应与二肽基肽酶Ⅳ抑制剂(dipeptidyl peptidase Ⅳ inhibitor,DPP-4i)联合使用。GLP-1RA常见不良反应为胃肠道反应。GLP-1RA禁用于有甲状腺髓样癌病史或家族史患者、2型多发性内分泌腺瘤病患者等,有胰腺炎病史者慎用。
(三)其他降糖药物
口服降糖药物:二甲双胍、DPP-4i、胰岛素促泌剂(磺脲类和格列奈类)、α-糖苷酶抑制剂、噻唑烷二酮类(thiazolidinediones,TZDs),均为临床有效的降糖药物。DKD患者应用时应根据eGFR水平选择适用的降糖药物(附录6)。利格列汀(DPP-4i)、那格列奈(胰岛素促泌剂)、罗格列酮和吡格列酮(TZDs)在肾功能不全患者中无需调整剂量,可全程应用。DKD患者服用二甲双胍期间需监测eGFR变化,eGFR 45~59 ml·min-1·1.73 m-2时应减量,eGFR<45 ml·min-1·1.73 m-2时禁忌使用。CKD G3a期及以下患者在使用造影剂及全身麻醉前需暂停二甲双胍,完成后48 h复查肾功能无恶化再启用。
胰岛素:由于肾功能不全时肾脏对胰岛素清除减少,可导致体内蓄积,胰岛素使用过程注意密切监测血糖,及时调整胰岛素剂量,避免低血糖发生。
四、降压治疗
DKD患者常伴有高血压,高血压加速肾病进展,同时也影响CVD预后。控制高血压可有效降低DKD患者的尿蛋白水平,延缓肾功能恶化,降低CVD终点事件(如卒中、心肌梗死、CVD相关死亡等)的发生风险。不同肾功能状态下降压药物的使用可参考附录8。
对于DKD合并高血压患者,初始降压治疗首选ACEI/ARB类降压药,并逐步加量至可耐受的最大安全剂量。ACEI/ARB类降压药不仅具有降压作用,还能够降低尿蛋白、延缓肾功能下降、改善预后,并且其肾脏保护作用独立于降压作用之外。开始应用ACEI/ARB类或剂量增加后2~4周内监测血压、血肌酐、血钾水平,如4周内血肌酐升高超过30%,需停药或减少剂量并寻找急性肾损伤的原因(如肾动脉狭窄);不建议联合应用ACEI和ARB。出现与ACEI/ARB应用相关的高钾血症时须停药,并转诊至上级医疗机构。
使用ACEI/ARB的DKD患者如血压控制未达标,可在ACEI/ARB的基础上,联用钙通道阻滞剂(calcium channel blocker,CCB)或噻嗪类利尿剂/袢利尿剂(eGFR<30 ml·min-1·1.73 m-2时使用袢利尿剂)。如果两药联合使用血压未能控制,则推荐使用ACEI/ARB、CCB、利尿剂三药联合。在联合用药时,推荐单片固定复方制剂(ARB+CCB、ARB/ACEI+利尿剂),固定复方制剂在疗效、依从性和安全性方面均优于上述药物自由联合。
五、调脂及抗血小板治疗
DKD患者的血脂控制目标与调脂治疗同一般T2DM患者。但临床用药时应根据肾功能水平进行药物选择和剂量调整,具体见附录9。
DKD合并CVD患者在使用抗血小板药物时应充分评估出血风险,并关注药物禁忌证。
六、其他DKD获益药物
1.非甾体类盐皮质激素受体拮抗剂非奈利酮:非奈利酮作为新一代治疗药物,通过阻断盐皮质激素受体过度活化而降低T2DM相关且伴白蛋白尿的CKD患者eGFR持续下降、ESRD、心血管死亡和因心力衰竭住院的风险。在T2DM伴白蛋白尿、eGFR≥25 ml·min-1·1.73 m-2、血清钾浓度≤5.0 mmol/L的患者中,推荐加用对肾脏和心血管有益的非奈利酮。一般起始剂量应为20 mg,每日1次;eGFR 25~59 ml·min-1·1.73 m-2减量至10 mg,每日1次,具体详见表5。非奈利酮常见的不良反应为高钾血症,因此开始治疗、剂量调整的4周内,及整个治疗期间需监测血钾,血钾>5.5 mmol/L停药,具体详见表6。


2.中成药治疗:黄葵胶囊可用于治疗DKD,单药使用时与ARB有相似的降尿蛋白疗效,与ARB联用时能够在ARB的基础上进一步降低尿蛋白的水平。另外,以黄芪等中药组成的糖肾方在ACEI/ARB的基础上也能进一步降低尿蛋白。
七、基层腹膜透析管理
腹膜透析技术下沉至基层医疗卫生机构可以优化医疗资源配置,方便患者就近就医,减少时间及经济成本。基层医疗卫生机构医务人员应普及腹膜透析相关知识,进行腹膜透析相关的理论及实践学习,完成腹膜透析专业知识的系统培训,取得腹膜透析培训证书,方可进行腹膜透析的相关随访工作。同时,还应与上级医疗机构建立良好的互动及转诊策略。即使是在社区随访的患者,仍由上级医院进行患者的全面管理。
患者随访
对接受国家基本公共卫生服务项目糖尿病健康管理服务的患者,按照国家有关规范和要求随访,每年随访不少于4次。随访包括以下内容。
1.了解患者症状、生活方式、辅助检查结果、血糖控制情况、肾脏损伤情况及其用药情况。
2.检测血压、空腹/餐后血糖,推荐检测HbA1c。
3.对患者提出运动和合理营养建议。
4.随访信息可参照填入“糖尿病肾脏病患者随访管理服务记录表”(附录10)。
对于糖尿病患者的临床诊疗,基层医疗卫生机构参照《国家基层糖尿病防治管理指南(2022)》中有关并发症及合并症的检查要求执行,每6个月至少开展1次尿常规检查,每年进行1次血脂、肝肾功能检测和DKD筛查。
对于已确诊DKD患者,应根据CKD分期(G1~G5)和白蛋白尿分期(A1~A3)确定随访频率,以评估疾病进展、指导治疗方案调整等(表1)。对于eGFR<60 ml·min-1·1.73 m-2的患者还应监测CKD并发症情况,如贫血、矿物质及骨代谢紊乱等。
转诊
一、建议上转至二级及以上医院的情况
(一)筛查困难
无法提供DKD筛查的基层医疗机构,建议向上转诊,完善检查。
(二)指征明确
已诊断的DKD患者中,UACR>300 mg/g或CKD临床分期G4、G5期者。
(三)诊断不明
糖尿病患者伴肾脏损害,DKD临床诊断难以明确时,如出现明显的镜下血尿(尿红细胞≥20个/高倍镜或尿红细胞≥80个/μl或尿潜血≥2+)等(具体参照本指南“糖尿病肾脏病筛查、诊断与临床分期”章节)。
(四)治疗复杂
对综合治疗方案的制定、评估、处理有困难者,如血糖、血压治疗长期不达标者,或糖尿病慢性并发症导致严重靶器官损害需要紧急救治者。
(五)其他情况
进行腹膜透析的DKD患者至少每3个月需至上级医院进行规律随访1次。另外,出现腹膜透析相关并发症(感染和/或非感染并发症),或心力衰竭、严重贫血、电解质及酸碱平衡紊乱等其他社区医院无法处理者。
二、建议转回基层医疗卫生机构的情况
经上级医疗机构医生判定可以转回基层继续治疗管理的患者。
指南撰写组名单:贾伟平(上海交通大学医学院附属第六人民医院内分泌代谢科);朱大龙(南京大学医学院附属鼓楼医院内分泌科);蔡淳(上海交通大学医学院附属第六人民医院 国家基本公共卫生服务项目基层糖尿病防治管理办公室);陈莉明(天津医科大学朱宪彝纪念医院内分泌科);陈丽(山东大学齐鲁医院内分泌科);李红(浙江大学医学院附属邵逸夫医院内分泌代谢科);薛耀明(南方医科大学南方医院内分泌代谢科);李启富(重庆医科大学附属第一医院内分泌科);包玉倩(上海交通大学医学院附属第六人民医院内分泌代谢科);张俊清(北京大学第一医院内分泌科);徐玉善(昆明医科大学第一附属医院内分泌科);吴天凤(浙江医院内分泌科);汪年松(上海交通大学医学院附属第六人民医院肾脏科);居漪(上海市临床检验中心);吴浩(首都医科大学全科医学与继续教育学院);殷峻(上海交通大学医学院附属第六人民医院内分泌代谢科);范瑛(上海交通大学医学院附属第六人民医院肾脏科);宋君(同济大学附属东方医院内分泌科);王月环(江苏省常州市钟楼区五星街道社区卫生服务中心);史玲(上海市普陀区卫生健康事务管理中心);励丽(宁波大学附属第一医院内分泌科);葛声(上海交通大学医学院附属第六人民医院临床营养科);黄珊(上海交通大学医学院附属同仁医院内分泌科)
起草工作组名单:蔡淳;李红;包玉倩;殷峻;宋君;范瑛;励丽;黄珊;彭丹凤(上海交通大学医学院附属第六人民医院内分泌代谢科);余蓉(上海交通大学医学院附属第六人民医院 上海市糖尿病研究所)
附录1
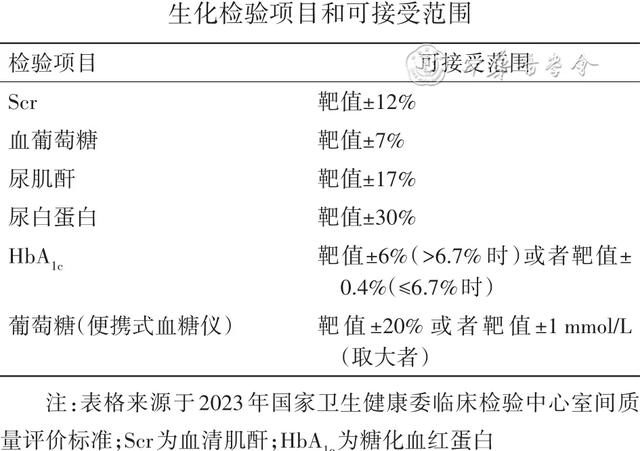
附录2

附录3

附录4 eGFR计算公式
eGFR使用慢性肾脏病流行病学合作研究(CKD-EPI)公式进行计算。eGFR=142×min(SCr/κ,1)α×max(SCr/κ,1)-1.200×0.9938年龄×1.012(如为女性)(其中SCr为血清肌酐水平,单位为mg/dl;κ:女性=0.7,男性=0.9;α:女性=-0.241,男性=-0.302;min为SCr/κ与1的较小值;max为SCr/κ与1的较大值)。也可通过网站www.kidney.org/professionals/kdoqi/gfr_calculator进行计算(输入相应的年龄、性别、血肌酐水平)。
附录5 目标心率计算公式
最大心率(maximum heart rate,MHR)=220-年龄;目标心率(target heart rate,THR)=(MHR-静态心率)×(40%~70%)+静态心率
附录6 不同肾功能分期降糖药物的使用

附录7 降糖药物综合获益、风险评估表

附录8 不同肾功能分期降压类药物的使用

附录9 不同肾功能分期调脂药物的使用

附录10 糖尿病肾脏病患者随访管理服务记录表

注:体征和生活方式指导部分中,斜线前填写目前情况,斜线后填写下次随访时的目标,其中,运动部分横线上填写目前情况,横线下填写下次随访时的目标;eGFR为估算的肾小球滤过率;1 mmHg=0.133 kPa
本文编辑:赵景辉
