研究背景
弥漫中线胶质瘤(DMG)H3K27改变型是治疗困难的4级胶质瘤,这种肿瘤类型现在被分为四种亚型。然而,H3.3-K27M亚组在临床和分子上仍存在异质性。研究显示,罕见的H3.3K27M与BRAF或FGFR1改变并存的患者往往有更好的预后。伴有H3-K27M和MAPK通路改变的单个病例或小队列样本与DMG H3K27改变、BRAF和FGFR1野生型患者相比,可能具有更长的生存期。为了解这些改变如何改善肿瘤的预后,研究者分析了(影像学、组织学、基因组学、转录组和DNA甲基化分析)更大的DMG H3K27改变的病例队列,包括29个包含BRAF V600E或FGFR1MUT的肿瘤。
研究结果
1.DMG H3K27的基因组景观随BRAF/ FGFR1的改变而改变

图1DMG H3-K27M合并BRAF和FGFR1突变患者队列的临床和分子特征。60例出现BRAF或FGFR1突变的儿童和成人DMG H3-K27患者的临床和分子注释概述。病例以列表示,基因状态以行表示。年龄以年为单位。除免疫组织学数据(包括组织学分析、EZHIP和ATRX表达)外,所有分子信息均来自DNA或RNA测序分析。在最后的随访中仍然存活的患者用斜切的正方形表示。
研究者分析了一组H3K27改变的胶质瘤的队列,其中包含BRAF(n=22)、FGFR(n=37)或含有两者的突变(n=1)。其中,43名为儿童(<18岁),16名为成人。同时,分析了来自相应队列的BRAFWT/ FGFRWT DMG H3-K27患者的对照组病例。所有具有BRAF改变的DMG H3-K27M均带有体细胞V600E突变,但没有融合(图1)。在FGFR方面,所有病例均显示FGFR1热点替代。N546K/D(73%,27/37)和/或K656E/M(23%,11/37)优先发生在中枢神经系统肿瘤中,但既没有FGFR1融合/重复,也没有FGFR2/3改变(图1)。
BRAFMUT或FGFR1MUT主要与H3.3-K27M突变相关,而与H3.1-K27M突变无关。BRAF和FGFR1突变是相互排斥的,因为只有一个肿瘤同时出现了这两种结果(病例#23;图1)。在90%(9/10)的FGFR1MUT病例中,FGFR1突变与H3-3A突变克隆,具有相似的变异等位基因频率,表明在这些肿瘤发生的早期步骤中发挥了作用。
DMG H3-K27M BRAFV600E患者的情况较少,只有33%(2/6)的肿瘤出现BRAF突变克隆到H3-K27M突变。此外,H3-K27 FGFR1MUT肿瘤经常在MAPK通路中出现其他突变,NF1(13/31;32%)或PTPN11(3/22;13.6%)是最常见的突变基因(图1)。在BRAFMUT和FGFR1MUT肿瘤中,有5%(1/20)和9.3%(3/32)中分别发现TP53突变(图1)。
此外,ATRX在59.3%(16/27)的FGFR1MUT DMG中发生突变或IHC表达缺失。在19%的H3-K27M(4/21)的FGFR1MUT肿瘤中,PI3K/AKT/mTOR信号通路成员存在突变(图1)。
2.BRAFMUT/FGFR1MUTH3K27改变的肿瘤在组织学上具有异质性,常伴有混合的弥漫-局限性表现和钙化

图2具有BRAF或FGFR1突变的DMG H3-K27的组织病理学特征。病例14·a胶质神经元增生,伴有神经节细胞、嗜酸性粒细胞颗粒体和微钙化物。病例11·b为神经胶质神经元增殖,伴有大量神经节细胞。病例13·c为神经胶质神经元增生,伴有大量神经节细胞和淋巴细胞膨胀。病例31·d主要为局限性增生。病例32·e主要是局限性增生,在肿瘤周围有一个融合成分f。g溶解嗜铬粒蛋白免疫反应性染色神经元细胞。h·BRAF V600E在包括神经节细胞在内的所有肿瘤细胞中的表达。i·H3K27M在包括神经节细胞在内的所有肿瘤细胞中的表达。病例7·j为神经胶质细胞增生,具有低钙化样特征和微钙化特征。病例11 k·H3K27me3的整体缺失。l肿瘤细胞中ATRX的缺失。m·GFAP旋涡(×20)。n·GFAP旋涡(×400),o·GFAP抗体染色。
接下来,研究者分析了自己的队列中病例的组织病理学特征。这29例肿瘤最初被诊断为DMG H3K27(n=13)、神经节胶质瘤1级(n=5)、间变性神经节胶质瘤3级(n=4)或其他胶质瘤(GBM n=3;毛细胞星形细胞瘤n=1;LGG n=1或少突星形细胞瘤3 级,n=2)。所有BRAFMUT/FGFR1MUT DMG均如预期的一样出现H3K27三甲基化缺失,H3K27M染色阳性,但EZHIP过表达的病例除外。
观察到三种主要的组织学模式:41.3%的GG样(12/29),34.4%的DMG样(10/29),24.3%的带有毛状星形细胞成分的HGG(piloid-HGG)(7/29)。BRAFMUT和FGFR1MUT肿瘤分别仅在25%(4/16)和46%(6/13)的病例中呈现出典型的DMG组织学特征。在BRAFMUT或FGFR1MUT病例中50%(8/16)和30%(4/13)以混合神经元和胶质肿瘤细胞为特征(图2b-i)。25%(4/16)的BRAFMUT和23%(3/13)的FGFR1MUT DMG呈现具有毛细胞形态的piloid-HGG形态(图2j,k)。
其余的FGFR1MUT DMG病例(3/13)包含混合的DMG样和GG样或piloid-HGG, GG样和piloid-HGG(图2l)。虽然在经典DMG中很罕见,但在56%(36)和38%(5/13)DMG中观察到微钙化(图2j)。GFAP旋涡成了一个小的结节,代表了罕见但特殊的情况(n=4)(图2m-o)。

图3 DMG H3-K27M BRAF V600E或FGFR1MUT的影像学特异性。根据BRAF或FGFR1突变状态,aT2-flair MR图像序列或CT。b根据其基因型比较DMG的肿瘤影像学表现(融合、局限或混合)。c根据MAPK改变的存在,比较DMG CT扫描中大钙化的存在。
影像学上,DMG H3-K27 BRAFMUT或FGFR1MUT多为弥漫性,但与对照DMG H3-K27相比,混合结节型明显富集(图3a-b)。很少有肿瘤完全局限(图3a、b),进展时的影像学分析发现一半的弥漫进化模式(2/4)。
它们比DMG H3-K27出现更多的钙化(图3a,c)。总的来说,在组织学和影像学分析中,DMG H3K27M BRAFMUT或FGFR1MUT分别为8/11(72.7%)和6/9(66.7%)发生钙化。
3.DNA甲基化分析区分了由MAPK激活突变改变的DMG H3K27的一个亚群

图4 DMG H3.3-K27M BRAFMUT/FGFR1MUT的DNA甲基化谱分析。基于DNA甲基化分析的中枢神经系统肿瘤分类。
分析整个队列的DNA甲基化谱, 54%(7/13)的BRAFMUT和67%(10/15)的FGFRMUT肿瘤分类为DMG_K27,其余对应其他类别或未分类(评分<0.9)。
4.BRAF和FGFR1突变状态是儿童和成人DMG H3K27改变型预后因素
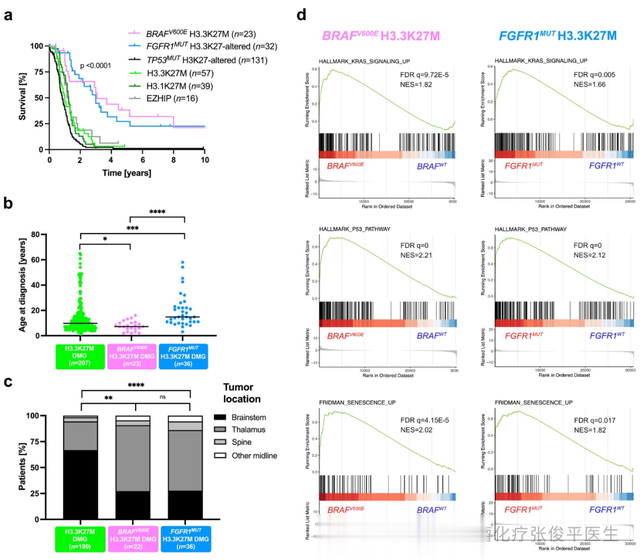
图5 DMG H3-K27M BRAFMUT/FGFR1MUT和转录组肿瘤特征患者的临床特征。a比较根据组蛋白H3、BRAF、FGFR1和TP53突变状态的OS。b根据BRAF和FGFR1突变状态诊断时的年龄分布。c根据BRAF和FGFR1的突变状态比较肿瘤位置。d GSEA图显示DMG H3.3-K27M的共同转录组特征。
TP53突变和BRAFV600E/FGFR1突变在DMG中大多相互排斥。为了避免TP53突变对没有MAPK激活改变的H3.3-K27M DMG结果的混淆,在Kaplan-Meier总生存期(OS)分析中对两组组蛋白H3和TP53基因型患者进行了分层。与DMG H3.3-K27M TP53WT和其他DMG亚型相比(中位OS为12个月),对于激活BRAF的(中位OS为37个月)或FGFR1突变(中位OS 36个月)儿童和成人DMG H3-K27患者的OS明显更好(图5a)。
表1 H3-K27M DMG患者OS的多变量Cox比例风险回归模型

多变量分析显示,组蛋白H3和TP53状态与OS显著相关(表1)。年龄与预后显著相关,但与其他变量相比,其总体影响有限。BRAF V600E和FGFR1MUT是H3K27改变的DMG中强的和独立的预后标志物(表1)。
5.DMG H3K27M BRAF/FGFR1突变的儿童和成人患者的临床差异
在具有MAPK激活突变的DMG中,男女比例相当。在诊断时,H3.3-K27M DMG、BRAFMUT和FGFR1MUT DMG之间存在显著的年龄差异(图5b)。相比之下,FGFR1MUT患者的诊断年龄比FGFR1WT患者明显更高,中位年龄分别为14.8年和9.8年(图5b)。与DMG H3.3-K27M相比,具有BRAF和FGFR1突变的DMG在丘脑中明显更常见(图5c)。
6.在肿瘤发生过程中,H3.3K27M突变发生在BRAF V600E之前
接下来,我们想知道在这些肿瘤中突变的序列是否相同,更主要的是它们是否对应于(i) DMG(H3-K27M作为“第一次打击”)或(ii)非典型侵袭性低级别胶质瘤(BRAFV600E作为“第一次打击”)。研究者通过数字液滴PCR对一个BRAFV600E H3.3- K27M肿瘤(病例#2)和一个H3.3- K27M BRAFWT克隆的基因组DNA进行了BRAF拷贝数变异(CNV)分析。BRAFWT克隆有两个BRAF等位基因,因此是由仅H3.3 - K27M的祖先克隆的重新扩增造成的,而不是由BRAF V600E等位基因的遗传丢失造成的,这表明,在1例DMG H3.3-K27M BRAF V600E中,H3.3-K27M为首发突变。
7.具有MAPK改变的DMG H3.3K27M显示出衰老的转录组特征,并上调CDKN1A(P21)
H3.3K27M BRAFWTDMG与H3.3-K27M BRAFV600E DMG比,676个显著上调基因和633个下调基因,H3.3-K27M FGFR1WTDMG与H3.3-K27M FGFR1MUT DMG比,228个上调基因和274个下调基因。94个上调基因和111个下调基因是2个比较中共同的。在BRAFMUT和FGFR1MUT DMG中MAPK信号和PI3K/AKT/MTOR信号标签的富集(图5d)以及血管生成和缺氧标签富集。此外,与仅H3.3-K27M突变的患者相比,编码衰老标志物P21的CDKN1A基因在BRAFMUT和FGFR1MUT胶质瘤中RNA水平过表达。
讨论
本研究数据支持另一种DMG新亚型,该亚型具有独特的组织学、放射学、临床、基因组、转录组和表观遗传学特征,我们暂时将其称为DMG,H3 K27和BRAF/FGFR1共改变(DMG_K27-BRAF/FGFR1),这可能代表DMG H3 K27改变型的20%。DMG_K27- BRAF/FGFR1可能具有不同的细胞来源,能够表现出胶质和神经元的混合分化,主要在BRAF亚类中最明显。基因型-形态型相关性支持区分经典DMG、H3K27改变和胶质/胶质神经元肿瘤MAPK-改变。其他一些临床和生物学特征支持从经典的DMG,H3K27改变的肿瘤中新分类。首先,OS与经典的DMG_K27明显不同。此外,多变量分析首次表明,这些突变的存在是DMG_K27中OS改善的独立预后因素。BRAF/FGFR1突变DMG_K27的一个队列接受了长时间的相当异质性的治疗,未得出特定的统计结论。因此,这些患者是否能对针对BRAFV600E或FGFR1的靶向治疗有反应还有待确定。
另一个有意义的差异是,与来自H3.3-K27M亚型的DMG相比,DMG_K27-BRAF/ FGFR1在丘脑中比在脑干中更常见。诊断时的年龄也根据MAPK改变的存在而变化。研究者还观察到一种衰老特征。值得注意的是,DMG_K27-BRAF/FGFR1与LGGs具有其他共同的特征,如钙化和突变的优先关联。H3.3K27M是肿瘤发生过程中的第一个突变事件,BRAF和FGFR1突变将是肿瘤发生的次要驱动事件,并可能为H3.3-K27M祖先克隆提供增殖优势。扩展DMG_K27-MAPK肿瘤发生中突变序列获得的分析对于设计未来的治疗干预措施至关重要。
参考文献:Auffret L, Ajlil Y, Tauziède-Espariat A, et al. A new subtype of diffuse midline glioma, H3 K27 and BRAF/FGFR1 co-altered: a clinico-radiological and histomolecular characterisation. Acta Neuropathol. 2023;147(1):2. Published 2023 Dec 8. doi:10.1007/s00401-023-02651-4
敬请注意:本文仅供相关专业人员学习参考之用,文中的所有信息均不作为诊断和治疗疾病的依据。如出现文中描述的症状,请及时就医。另外,本文仅节选原文的一部分,内容可能不完整或与原文存在偏差,若需更完整的信息请参阅原文。
撰稿:赵传
审校:张俊平,赵传
排版:张雅琪
