在X4 Pharma的XOLREMDI获得FDA批准后,患有罕见疾病WHIM综合征的患者现在有了第一个批准的治疗方法。这种药物针对CXCR4通路功能障碍,即WHIM综合征的根本病因。
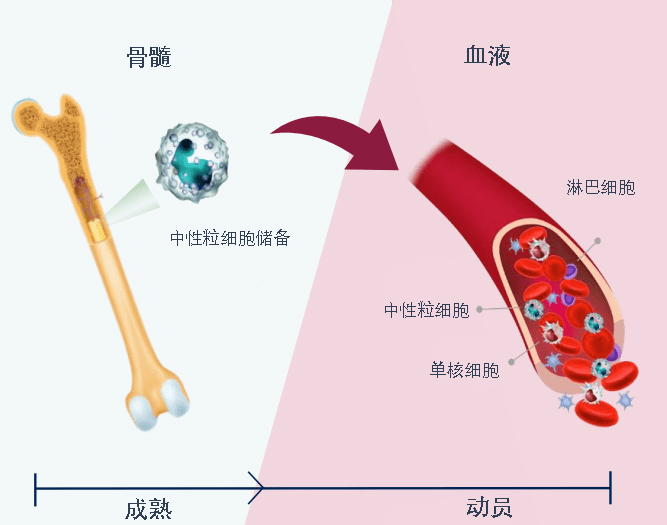
据X4 Pharma昨日宣布,美国食品药品监督管理局(FDA)已批准XOLREMDI(mavorixafor)用于治疗12岁及以上WHIM综合征(疣、低丙种球蛋白血症、感染和骨髓粒细胞缺乏症)患者,以增加循环中成熟中性粒细胞和淋巴细胞的数量。
WHIM综合征因其四种典型表现而得名:疣、低丙种球蛋白血症(抗体水平低)、感染和骨髓粒细胞缺乏症(白细胞计数低),WHIM是这四种临床表现的英文首字母缩写。这是一种遗传性免疫缺陷,由趋化因子受体(CXCR4)基因功能获得性突变引起。其突变导致对CXCR4配体CXCL12的反应性增强,并导致白细胞在骨髓中的滞留。这种罕见疾病没有标准的治疗方法,可以通过各种疗法来治疗其症状和频繁感染。
目前,WHIM综合征患者主要接受超适应症G-CSF或GM-CSF药物(如非格司亭或沙格司亭)治疗,以对抗中性粒细胞减少症,或接受通过注射或输注提供的免疫球蛋白替代疗法,并且往往需要常规抗生素来减少慢性细菌感染的频率。
XOLREMDI是第一种专门用于WHIM综合征患者的治疗方法。这是一种选择性CXC趋化因子受体4(CXCR4)拮抗剂,通过阻断CXCL12的结合起作用,实现中性粒细胞和淋巴细胞从骨髓动员到外周循环的增加。
XOLREMDI的批准基于随机、双盲、安慰剂对照3期试验4WHIM(NCT03995108)的数据,该试验评估了mavorixafor在31名12岁及以上WHIM综合征患者中的疗效和安全性。
研究受试者被随机分配接受每日一次口服mavorixafor(n=14)或安慰剂(n=17)。疗效基于绝对中性粒细胞计数的改善、绝对淋巴细胞计数的改善以及感染的减少。
研究结果显示,与安慰剂相比,mavorixafor与绝对中性粒细胞计数(最小二乘[LS]平均值[SE]:分别为15.0[1.89]小时与2.8[1.52]小时;P<0.0001)和绝对淋巴细胞计数(LSSE:分别为15.8[1.39]小时与4.6[1.5]小时;P<0.0001)高于阈值水平的时间有统计学意义和临床相关性。与安慰剂相比,mavorixafor治疗还可以降低感染的发生率、严重程度和持续时间。
Mavorixafor最常见的不良反应是血小板减少、糠疹、皮疹、鼻炎、鼻衄、呕吐和头晕。
参考来源:‘X4 Pharmaceuticals Announces FDA Approval of XOLREMDI™ (mavorixafor) Capsules, First Drug Indicated in Patients with WHIM Syndrome’,新闻稿。X4 Pharmaceuticals;2024年4月29日发布。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。
