在以往研究中,在研治疗性乙肝疫苗 VVX001,是一种可以诱导preS特异性免疫应答反应的潜在乙肝候选药物。2022年欧肝会上(EASL2022),研究人员以题为:通过对乙肝e抗原(HBeAg)阴性慢乙肝受试者使用基于 pre-s 的治疗性疫苗VVX001进行接种中可诱导抗pre-s抗体反应-中期分析,发布在本届欧肝会上。

乙肝在研新药VVX001,诱导preS特异性反应,87%停核苷后无需重复
研究人员介绍,VVX001是一种在研治疗性乙肝疫苗候选药物,基于与草花粉过敏原肽融合的HBV衍生的preS。进行这项前瞻性、双盲、安慰剂对照试验的目的是(临床试验编号:NCT03625934),研究VVX001是否可以在包括慢乙肝受试者在内的 4 个不同队列中,诱导 preS 特异性抗体和T细胞免疫应答反应。
结果表明,参与本研究的所有20名受试者均完成治疗(男/女比例为 16:4,19名为高加索人,1名为亚洲人,年龄:35-59岁),其中有17名受试者完成了9次就诊。5名受试者接受安慰剂,15名接种 VXX001。
在积极治疗组中(Verum),所有受试者都出现了强烈的 preS特异性 lgG反应,在最后一次注射后一个月达到峰值,并在第12个月下降。在第8次就诊时(最后一次注射后12周),preS 特异性 IgG水平与基线相比增加了 139%(中位数)(p<0.001)。
积极治疗组在随访结束时,乙肝表面抗原(HBsAg)中位数从 365 IU/ml(范围:100 至 1320)下降到 116(0-340)(9 人;p=0.04),而在安慰剂组中(n = 4)并未观察到这一下降现象。
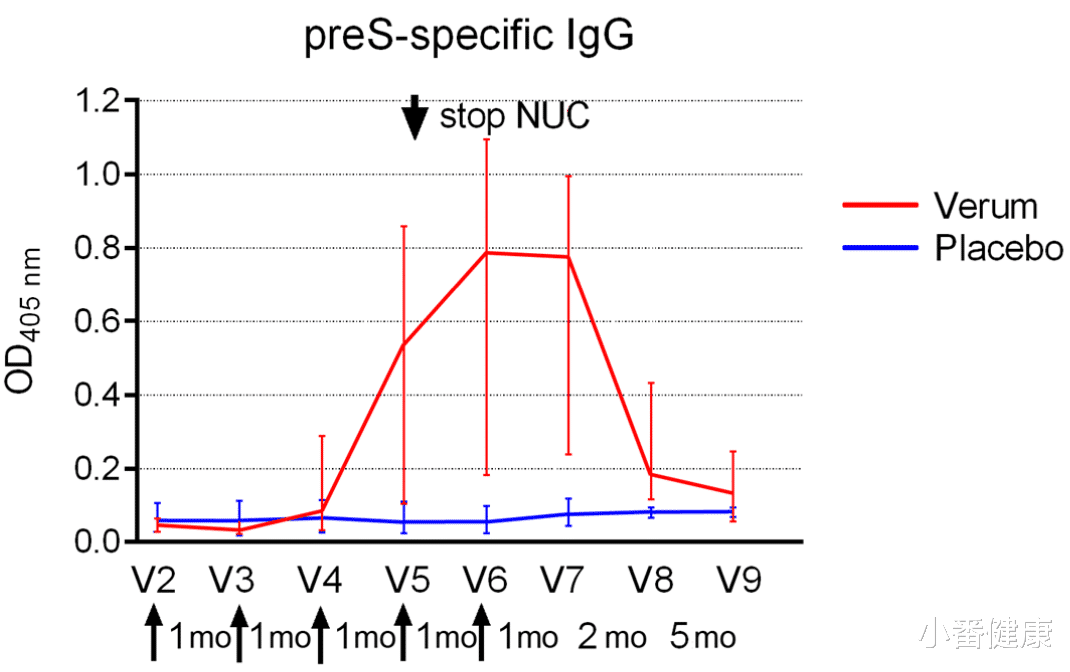
在随访期间,积极治疗组中有6名受试者的HBVDNA变得可量化;2名受试者出现 ALT 升高 > 正常上限 (ULN) 的 10 倍,并重新开始使用核苷类药物。1名受试者出现短暂的ALT升高(7xULN)。在该名受试者和另外3名受试者中,HBVDNA再次降至 20 IU/ml 以下水平。积极治疗组中有13名受试者(87%)的 HBVDNA仍为阴性,ALT正常,并且没有人需要重复NUC治疗。
安全性方面,除局部的注射反应外,在所有受试者中,VVX001均具有良好的耐受性,且未出现严重不良事件(SAEs)(本研究方法已省略)。
综上所述,研究人员给出结论是:VVX001具有良好的安全性与耐受性,可以在乙肝e抗原阴性慢乙肝受试者中诱导 preS 特异性免疫反应。在 87% 比例接受该候选疫苗的受试者中,当停止使用核苷类后,他们无需重复再使用核苷类。需要更长的随访时间,以评估 VVX001 疫苗接种和停用核苷类的长期影响。

小番健康结语:在研治疗性乙肝疫苗VVX001,是全球停留在2期研究时间比较长的乙肝候选药物(2018年年中已登记2期,至今依然处在2期),由Viravaxx AG公司自主研发。早在去年的HEP DART 2021大会上,Viravaxx AG公司与奥地利维也纳医科大学特殊预防研究所的研究人员已公布过该HBV候选疫苗的一项中期分析结论,该结论与本届欧肝会上发布的结果基本一致。
研究人员旨在说明,在去年的HEP DART 2021大会已介绍过这种在研治疗性疫苗可以在慢乙肝受试者中,诱导 preS 特异性免疫应答,研究期间,具有安全性且耐受性良好,并且未报告SAEs,正在观察 VVX001 是否也能在停用核苷类的乙肝e抗原阴性受试者中(队列4a)中,同样诱导这种 preS 特异性免疫应答。
结果表明,在本届欧肝会上更新的研究中,有 87%接种该候选疫苗的受试者,当停用核苷类后不需要重复使用核苷类,目前,研究人员正通过更长的随访来观察停用核苷类后的影响及继续评估HBV候选疫苗 VVX001,这个结论也和HEP DART 2021大会上公布的结果一致。
