本文来源:白血病·淋巴瘤, 2024,33(3) : 129-137.
原发性中枢神经系统淋巴瘤(PCNSL)是罕见类型的结外非霍奇金淋巴瘤,病灶范围局限于脑实质、脊髓、软脑膜和眼。95%以上患者的病理类型为弥漫大B细胞淋巴瘤。世界卫生组织(WHO)将PCNSL归类为弥漫大B细胞淋巴瘤的一个独特亚型,属于免疫豁免部位的大B细胞淋巴瘤。PCNSL是所有非霍奇金淋巴瘤中预后最差的类型。
PCNSL的诊断和治疗已有一些共识、指南,包括欧洲神经肿瘤学会(EANO)(2023年)及英国血液学学会(BSH)(2019年)发布的指南。美国国家综合癌症网络(NCCN)指南将PCNSL作为中枢神经系统肿瘤的一部分定期更新。中国临床肿瘤学会(CSCO)指南将PCNSL作为淋巴瘤指南的一部分制定和发布。2022年发表的《原发性中枢神经系统淋巴瘤治疗的中国专家循证共识》(英文版)对诊断和治疗中的重要临床问题进行了循证推荐。由于PCNSL临床罕见,对该疾病的认识尚未统一,诊治有待进一步规范。为加强我国临床医师对PCNSL的认知,提高诊断和治疗水平,中华医学会血液学分会淋巴细胞疾病学组、中国临床肿瘤学会(CSCO)淋巴瘤专家委员会相关专家参考国内外指南及共识并结合最新的研究进展,讨论并制定本共识。
1 概述
PCNSL是一种罕见的非霍奇金淋巴瘤,病灶仅累及脑实质、脊髓、软脑膜或眼,而无全身性淋巴瘤的证据。年发病率为(0.4~0.5)/10万,占新诊断脑肿瘤的3%~4%、结外淋巴瘤的4%~6%。可发生在任何年龄段,中位发病年龄65岁。PCNSL的病理生理机制尚未完全清楚,最新研究认为B细胞受体(BCR)和Toll样受体(TLR)信号通路,以及免疫逃逸和免疫抑制性肿瘤微环境是其关键的发病机制。先天或后天获得性免疫缺陷患者PCNSL的发病率远高于免疫正常者。PCNSL的神经功能和体能状态恶化通常较快,临床症状亦缺乏特异性,早期快速诊断一般比较困难,然而PCNSL高侵袭、病程进展较快且预后差,因此早期快速诊断和及时有效治疗尤为重要。
2 临床表现
PCNSL病程大多在半年内,主要症状和体征因神经系统受累区域而异,但系统性淋巴瘤的常见B组症状(发热、盗汗和体质量减轻)在PCNSL中罕见。脑部受累症状(占30%~50%):主要表现为头痛、神经功能缺损症状(肌力下降、感觉变化、意识水平下降、共济失调)、神经精神和行为变化(抑郁、人格改变、淡漠、思维迟钝、冲动行为、幻觉)、颅内压升高、癫痫发作等。软脑膜受累症状(占10%~25%):主要表现为头晕、头痛、恶心、呕吐、颈背部僵硬等。眼受累症状(占10%~20%):主要表现为视物模糊、视力下降、飞蚊症等。脊髓受累症状(<1%):通常表现为亚急性脊髓病、脊柱疼痛、下运动神经元综合征等。
3 检查
3.1 影像学表现
影像学检查可显示颅内病变的位置、大小和形状,有助于PCNSL的诊断、鉴别诊断、分期和疗效监测。PCNSL的CT表现:多呈稍高密度肿块,形态不规则,呈团块状或类圆形,增强检查呈团块状或"握拳"样均匀性强化。增强CT通常作为无法行增强磁共振成像(MRI)检查的替代选择。PCNSL的PET-CT表现:PET-CT对PCNSL病变很敏感,有助于确定肿瘤的范围,在初次诊断和疑似复发时可作为诊断和分期的方法之一。病灶呈显著高摄取,当最大标准摄取值(SUVmax)>15时,有助于PCNSL诊断。PET-CT在PCNSL疗效监测中的地位尚无定论。PCNSL的MRI表现:平扫T1WI多表现为等或稍低信号,T2WI多表现为等或稍高信号,内部有坏死时T2WI为高信号;增强扫描多呈明显均匀强化,肿瘤坏死时可强化不均。PCNSL的增强MRI表现因患者的免疫状态而异。在免疫功能正常的患者中,增强扫描常表现为"拳头""切口"或"有角"征,而大多数免疫缺陷患者表现为环形强化。增强MRI是PCNSL诊断和疗效评估的优选检查。功能MRI表现:扩散加权成像(DWI)表现呈稍高信号,表观扩散系数(ADC)值降低。灌注加权成像(PWI)表现为肿瘤新生血管少,PCNSL灌注相对低于其他颅脑恶性肿瘤。核磁共振波谱(MRS)表现:瘤细胞致密导致Cho峰升高,部分淋巴瘤可出现具有特征性的Lip峰。
3.2 病理学检查
约95% PCNSL患者的病理类型为弥漫大B细胞淋巴瘤,少数为伯基特淋巴瘤、淋巴母细胞淋巴瘤、边缘区淋巴瘤或T细胞淋巴瘤。PCNSL为典型血管中心性生长模式,表达成熟B细胞的免疫标志,包括PAX5、CD19、CD20、CD22、CD79a、sIgM/IgD等,具有轻链限制性表达的特点。CD20阳性、CD3阴性是其典型免疫表型。bcl-2、bcl-6和IRF4/MUM1阳性表达率高。CD10多数情况阴性,若患者CD10阳性,应重点排查系统性淋巴瘤累及中枢神经系统。因糖皮质激素对PCNSL诊断影响大,若病情允许,在取得病理组织前应尽量避免使用糖皮质激素。
3.3 脑脊液检查
PCNSL患者脑脊液检查时蛋白和淋巴细胞计数常明显增高。对于仅脑膜受累或穿刺组织不足以明确诊断的患者,可联合其他辅助检查,如脑脊液流式细胞术、脑脊液细胞学检查、IgH基因重排、MYD88基因突变等。白细胞介素(IL)-6、IL-10、CXCL13等具有潜在诊断价值。
3.4 眼科检查
15%~25%的PCNSL患者存在眼部受累。所有患者均应进行全面的眼科评估,至少包括裂隙灯检查,以排除眼内受累。
3.5 认知功能评估
肿瘤本身和与治疗相关的神经毒性都会影响患者的认知功能,导致生命质量下降和社交能力受限。推荐对PCNSL患者的认知功能和生命质量进行评估,并进行终身随访。建议使用简易精神状态检查量表(MMSE)来评估认知功能。
3.6 基因检测
PCNSL存在多种遗传学异常,如9p24.1拷贝数异常/易位、bcl-6易位、6p21缺失等,但MYC及bcl-2易位很少见;近期发现多种常见基因突变,包括MYD88、CD79B、CDKN2A、PIM1等,其中MYD88L265P突变发生率明显高于系统性弥漫大B细胞淋巴瘤。Yuan等对中国人群68例初治PCNSL样本进行全基因组测序,发现最常见的突变基因为IGLL5、PIM1、MYD88、CD79B、BTG2、KMT2D、TBL1XR1、PCLO、HIST1H1E和BTG1。目前这些突变基因的预后价值尚无统一定论。Wang等研究显示在85.7%新诊断PCNSL患者的脑脊液游离DNA(cfDNA)中可以检测到≥1种突变基因,最常见的突变基因为MYD88、PIM1和KMT2D,cfDNA持续阳性的患者疾病进展更迅速,其比MRI可更早地预测疾病进展。随着相关靶向药物的临床应用,突变基因的筛查有助于PCNSL的精准治疗。
4 诊断、鉴别诊断、评估和分期
4.1 诊断
PCNSL的诊断可通过临床、影像学及组织病理学来综合诊断。影像学检查仅能提示PCNSL。PCNSL确诊依靠组织病理学和免疫组织化学。立体定向导航脑组织穿刺活组织检查是最为常用的获取病理标本的途径。CD20阳性、CD3阴性是典型免疫表型。对于疑难病例,可通过检测PCNSL特异性基因突变和脑脊液特征性细胞因子来提高诊断的灵敏度。活组织检查前应避免使用糖皮质激素。应对所有患者进行全面的眼科评估以排除眼内受累,建议对疑似原发性玻璃体视网膜淋巴瘤(PVRL)患者通过玻璃体活组织检查进行诊断。PCNSL患者的诊断流程见图1。
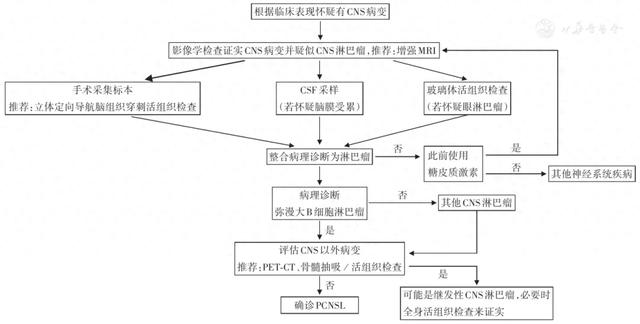
注:PCNSL为原发性中枢神经系统淋巴瘤;CNS为中枢神经系统;MRI为磁共振成像;CSF为脑脊液
▲图1 疑似PCNSL患者的诊断流程图
4.2 鉴别诊断
高级别脑胶质瘤:MRI信号明显不均匀,呈混杂T1/T2信号影,周边明显指状水肿影;占位征象明显,邻近脑室受压变形,中线结构移位,脑沟、脑池受压;增强扫描呈明显花环状及结节样异常强化影。颅内转移瘤:转移瘤多位于灰白质交界处,常多发,少数单发,MRI多呈长T1长T2信号,增强检查呈环形强化或结节样强化,肿瘤中心可有坏死;常表现为"小病灶大水肿";转移瘤患者一般有原发恶性肿瘤病史。颅内脱髓鞘样病变:与淋巴瘤易发生混淆的是肿瘤样脱髓鞘病变,增强扫描可见环形强化影,"开环征"为其较特异性征象,诊断性治疗后复查病变缩小明显,易复发,实验室检查有助于鉴别诊断。脑膜瘤:脑膜瘤多呈圆形或类圆形肿块,形态规则,瘤内囊变坏死少见,脑膜瘤内可见钙化灶;CT表现为稍高或高密度;MRI表现多为等T1等T2信号,增强检查时呈均匀强化,邻近脑膜可出现"脑膜尾征"。
4.3 评估
组织病理学确诊为PCNSL的患者均应接受诊断后评估(表1),以确定疾病范围、分期、预后和合并症,并排除系统性淋巴瘤。

4.4 分期
传统意义上的Ann Arbor分期不适用于PCNSL患者,目前尚无针对PCNSL的分期系统。目前主要采用国际结外淋巴瘤工作组(IELSG)和纪念斯隆凯特琳癌症中心(MSKCC)推荐的预后系统进行预后评估(表2、表3)。


5 治疗
鉴于淋巴瘤早期容易漏诊和误诊,治疗方法多样,且预后转归迥异,因此在诊治过程中需要重视多学科团队(MDT)的作用,以实现最大化整合诊治效果。PCNSL的MDT需整合神经外科、医学影像科、神经病理和分子病理、放疗科、血液内科、康复科、精神科、药理学等相关学科优势,以患者为中心,制订个体化整合诊治方案。一经确诊应尽早接受治疗。
手术切除病灶会延误化疗时机并且引起手术相关并发症,因此不作为常规推荐。全脑放疗曾是PCNSL的标准疗法,总反应率达80%以上,但多数患者复发迅速,总生存(OS)时间仅为12~17个月,目前全脑放疗不再作为一线治疗选择。基于大剂量甲氨蝶呤(HD-MTX)的联合治疗是目前PCNSL患者的一线治疗方案。PCNSL的当前治疗方案分为诱导、巩固及维持治疗三个阶段。在选择最佳治疗时除年龄因素外,还应考虑其他如ECOG评分、器官功能、合并疾病、神经毒性风险和社会经济情况等因素。鞘内注射化疗(如联合甲氨蝶呤、阿糖胞苷及地塞米松等药物),对于存在脑膜受累的患者有获益,但对于接受基于HD-MTX全身化疗的患者可以减免。
5.1 初治患者
新诊断PCNSL患者可归类为可耐受全身化疗的fit患者、无法耐受全身化疗的unfit患者。在整个治疗过程中应动态评估诱导、巩固和维持策略的适合度。此外应始终与患者讨论治疗的潜在获益和风险。新诊断患者的治疗流程见图2。

注:HD-MTX为大剂量甲氨蝶呤;BTKi为布鲁顿酪氨酸激酶抑制剂;CR为完全缓解;CRu为未证实的完全缓解;ASCT为自体造血干细胞移植;WBRT为全脑放疗;MATRix为HD-MTX+大剂量阿糖胞苷+利妥昔单抗+塞替派;MA±R:为HD-MTX+阿糖胞苷±利妥昔单抗;MT-R为HD-MTX+利妥昔单抗+替莫唑胺;MBVP为HD-MTX+替尼泊苷+卡莫司汀+泼尼松龙;R-MPV为利妥昔单抗+ HD-MTX+甲基苄肼+长春新碱;MR为HD-MTX+利妥昔单抗;R2-MTX为HD-MTX+利妥昔单抗+来那度胺;a用于年龄<70岁、器官功能良好、体能状态良好的患者;b>60岁患者应充分权衡利弊
▲图2 新诊断原发性中枢神经系统淋巴瘤患者的治疗流程图
5.1.1 可耐受全身化疗的患者(fit患者)
5.1.1.1 诱导治疗
HD-MTX(≥3.5 g/m2)可有效通过血脑屏障,是治疗PCNSL最为有效的基石药物。相比HD-MTX单药,在HD-MTX的基础上与其他化疗药物联合应用可进一步提高疗效。基于HD-MTX的联合化疗方案是目前PCNSL治疗的一线选择,包括MATRix、MA±R、MT-R、MBVP、R-MPV。IELSG32研究证实,MATRix方案较MA±R方案可进一步提高疗效。其他方案尚未在头对头研究中进行比较,因此尚未证实哪个联合方案具有优效性。因含有阿糖胞苷方案的血液学不良反应大,甲氨蝶呤联合甲基苄肼或替莫唑胺组合在老年患者中应用广泛。对于存在脊髓病变或脑脊液阳性的患者,可在化疗基础上联合鞘内注射化疗。
在HD-MTX输注前后,需要充分的水化、碱化、亚叶酸钙解救及甲氨蝶呤血清浓度监测等一系列措施。亚叶酸钙解救的终点为血浆甲氨蝶呤浓度到达临床安全浓度值以下,即<0.1 µmol/L。根据肌酐清除率或肾小球滤过率、结合叶酸代谢相关亚甲基四氢叶酸还原酶(MTHFR)基因多态性检测进行甲氨蝶呤剂量的个体化给药,有助于提高PCNSL患者甲氨蝶呤治疗的安全性。对于有肾脏疾病史或老年脆弱患者,治疗前需要进行全面评估,仔细考虑含甲氨蝶呤方案的不良反应,谨慎使用。
随着精准医疗的快速发展,靶向治疗有望进一步改善PCNSL预后。利妥昔单抗是靶向CD20的嵌合单克隆抗体,在CD20阳性的弥漫大B细胞淋巴瘤中具有显著活性。目前利妥昔单抗用于PCNSL的疗效仍存在争议。Ⅲ期大型随机对照临床研究HOVON 105/ALLG NHL 24结果表明,在新诊断PCNSL患者的治疗方案中加入利妥昔单抗并未提高疗效。相反,在IELSG 32研究中,HD-MTX+大剂量阿糖胞苷(HD-AraC)方案中添加利妥昔单抗治疗可显著改善新诊断患者的7年OS率。基于当前证据和NCCN指南建议,对新诊断的PCNSL-弥漫大B细胞淋巴瘤患者可在诱导治疗方案中联合利妥昔单抗。
鉴于布鲁顿酪氨酸激酶抑制剂(BTKi)及免疫调节剂等新药在复发难治PCNSL中的疗效,领域内众多专家尝试将这些新药前移至一线联合方案使用,早期研究结果令人鼓舞。Guo等开展的Ⅰ期临床研究显示,新诊断PCNSL患者在利妥昔单抗+HD-MTX的基础上联合伊布替尼诱导治疗后,客观缓解率(ORR)达到94%。Tang开展的回顾性研究显示,70岁以下新诊断PCNSL患者使用利妥昔单抗+甲氨蝶呤+阿糖胞苷联合泽布替尼方案诱导治疗的完全缓解(CR)率高达93%,安全性可控。Yuan等和Zhang等将来那度胺联合利妥昔单抗及甲氨蝶呤联合用于治疗新诊断PCNSL,ORR分别为91.7%和100%,最终研究结果值得期待。
5.1.1.2 巩固治疗
根据诱导治疗反应及耐受性选择后续巩固治疗方案。对于诱导化疗后获得CR或未证实的完全缓解(CRu)的患者,相较于全脑放疗,含塞替派的预处理方案联合自体造血干细胞移植(ASCT)是fit患者的首选,用于年龄<70岁、器官功能良好、体能状态良好的患者。两项随机对照研究(IELSG32研究和ANOCEF-GOELAMS研究)比较了诱导化疗缓解的患者后续进行全脑放疗或ASCT巩固治疗的效果差别,结果显示两种疗法均可取得很好的疾病控制,ANOCEF-GOELAMS研究显示ASCT组无进展生存(PFS)具有一定优势,两项研究均观察到全脑放疗组的远期神经系统不良反应更为明显。
对于获得CR/CRu但无法行ASCT治疗的患者,基于对神经系统不良反应和治疗效果的平衡,可考虑减低剂量的全脑放疗(45 Gy减量至23.4 Gy),但对于>60岁患者应充分权衡利弊。非清髓性化疗可能是无法行ASCT或全脑放疗患者的有效替代方案,包括HD-AraC±依托泊苷、每月1次HD-MTX为基础的方案巩固治疗满1年。
对于诱导治疗后仍有残留病灶患者的巩固治疗,化疗方案可选用HD-AraC±依托泊苷。挽救性全脑放疗前需要充分评估神经系统不良反应风险。最佳支持治疗仅适用于无法进行化疗和放疗的患者。
5.1.1.3 维持治疗
基于PCNSL的易复发性,建议维持治疗。但诱导治疗后维持治疗的地位,尚缺乏随机对照研究证据,循证医学推荐级别较低。对于某些老年或无法进行ASCT的患者,采用低剂量来那度胺、BTKi等药物维持有一定的获益,维持时间建议尽量满2年。一项研究评估来那度胺联合利妥昔单抗及HD-MTX诱导治疗后使用来那度胺维持治疗,整体表现出良好的应答率和安全性。另一项真实世界研究观察到BTKi联合HD-MTX用于治疗新诊断PCNSL患者的诱导治疗及后续维持治疗的临床获益,CR率和ORR分别达到64%和82%。替莫唑胺相关的Ⅲ期研究(JCOG1114C研究)未能证实在HD-MTX和全脑放疗标准治疗基础上加用替莫唑胺诱导治疗和维持治疗的生存获益。
5.1.2 unfit患者
无法耐受全身化疗的患者可选择全脑放疗、参加临床研究或姑息治疗。腰椎穿刺脑脊液检查或脊髓MRI检查阳性的患者可鞘内注射化疗或脊髓局部放疗。去化疗方案如BTKi、替莫唑胺、来那度胺单药及这几种药物与利妥昔单抗组合治疗方案在unfit患者中显示出良好疗效,并开始积极的一线治疗探索。Song等开展的多中心临床研究显示,老年不耐受化疗PCNSL患者接受泽布替尼联合来那度胺、替莫唑胺和利妥昔单抗作为一线治疗的ORR和CR率分别达91.7%和58.3%,18个月PFS率和OS率分别为80%和100%。
5.2 复发难治患者
尽管PCNSL的治疗取得了进展,但仍有患者对基于HD-MTX的化疗无应答(15%~25%)或在初始应答后复发(25%~50%)。一项队列分析显示,一线治疗后早期复发的患者结局较差(中位OS时间3.7个月),与难治患者相当(中位OS时间2.1个月)。复发主要发生在中枢神经系统,通常发生在与原发病变不同的部位。复发难治PCNSL患者治疗方案的选择取决于初始治疗方案和缓解持续时间,但尚无最佳方案推荐,优先考虑参加临床试验。复发难治患者的治疗流程见图3。

注:PCNSL为原发性中枢神经系统淋巴瘤;WBRT为全脑放疗;HD-MTX为大剂量甲氨蝶呤;ASCT为自体造血干细胞移植;BTKi为布鲁顿酪氨酸激酶抑制剂
▲图3 复发难治PCNSL患者的治疗流程图
对于既往全脑放疗治疗后复发的患者,考虑全身化疗±ASCT、局灶性放疗或姑息治疗。对于一线使用HD-MTX方案且未接受放疗的患者,若疗效维持1年以上,可重复使用基于HD-MTX的联合治疗或其他全身性化疗;若为早期复发(缓解时间<12个月),应转换为全颅脑或局部放疗、其他二线化疗方案。如能获得缓解,ASCT亦可作为巩固治疗。对于既往接受过大剂量化疗序贯ASCT的患者,若缓解时间≥12个月,可考虑第二次大剂量化疗联合干细胞挽救治疗、其他全身性化疗或姑息治疗;若治疗无反应或缓解时间<12个月,可考虑全脑放疗或局部放疗、其他全身性化疗或姑息治疗。除甲氨蝶呤再治疗外,挽救性化疗方案可包括HD-AraC联合依托泊苷、阿糖胞苷联合塞替派、替莫唑胺、培美曲塞等,可联合利妥昔单抗。
近年来BTKi、免疫调节剂等新药的逐渐加入为复发难治PCNSL患者提供了更多选择,可考虑在挽救性治疗中作为单药或联合其他化疗使用。一代BTKi总反应率50%~60%。二代BTKi(tirabrutinib)在日本已经获批用于复发难治PCNSL治疗。北京协和医院的一项回顾性分析提示二代BTKi泽布替尼具有更高的血脑屏障透过率,泽布替尼、奥布替尼和伊布替尼的脑脊液浓度与全身血药浓度的比值(CSF/IC50)分别为17.47、3.13和1.17。有研究报道含伊布替尼的TEDDi-R联合方案CR率高达83%,但继发真菌感染风险亦高达38%。法国眼脑淋巴瘤登记网络多中心临床研究显示,来那度胺联合利妥昔单抗方案ORR为35.6%。基于疗效证据,BTKi和来那度胺被NCCN和CSCO指南推荐。近年小宗病例报道嵌合抗原受体T细胞(CAR-T)治疗、免疫检查点抑制剂、免疫调节剂泊马度胺在复发难治PCNSL中有一定疗效,但仍需大宗病例研究证实。需要强调的是,各种新药单药治疗的PFS时间通常较短,需要探索新药之间及新药与化疗药物之间联合的治疗方案。
6 疗效评估和随访
国际PCNSL协作组(IPCG)结合MRI、眼科检查、脑脊液检查和糖皮质激素使用情况制定治疗反应评估标准,见表4。

患者应定期随访以了解生存状况,评估疾病状态,发现早期复发和转移,监测放化疗的远期不良反应,特别是神经系统不良反应。随访时间前2年每3个月随访1次,第3年至第5年每6个月随访1次,而后每年随访1次。此外,如患者有临床症状,则应立即随访。随访项目包括病史、体格检查、血液检查、颅脑增强MRI、认知功能评估等。若既往伴有脊柱病变时查脊柱影像学及脑脊液检测,若既往有眼部病变时行眼科检查,若怀疑有全身症状可行颈、胸、全腹及盆腔增强CT检查或PET-CT检查。
7 预后
常用IELSG和MSKCC推荐的预后体系进行综合预后评估。尽管随着治疗手段的不断进步,PCNSL的生存率有所提高,但预后仍然较差,尤其是老年患者。据统计,PCNSL中位OS时间为1.3年,3年预估OS率为37.7%(范围从仅接受放疗的14.1%至接受联合化疗的51.8%),5年预估OS率为30.5%。
执笔专家 钱文斌、袁相贵
参与共识讨论的专家(按姓氏汉语拼音字母排序) 白鸥(吉林大学第一医院)、崔国惠(华中科技大学同济医学院附属协和医院)、崔丽娟(宁夏医科大学总医院)、丁凯阳(安徽省肿瘤医院)、范磊(江苏省人民医院)、冯茹(南方医科大学南方医院)、傅建非(上海同济大学附属同济医院)、高力(陆军军医大学新桥医院)、郝思国(上海交通大学医学院附属新华医院)、贺鹏程(西安交通大学第一附属医院)、胡永仙(浙江大学医学院附属第一医院)、黄海雯(苏州大学附属第一医院)、黄洪晖(上海交通大学医学院附属仁济医院)、黄亮(华中科技大学同济医学院附属同济医院)、金正明(苏州大学附属第一医院)、李彩霞(苏州大学附属第一医院)、李菲(南昌大学第一附属医院)、李颢(山东大学齐鲁医院)、李建勇(江苏省人民医院)、刘辉(北京医院)、刘立根(上海交通大学医学院附属同仁医院)、刘沁华(安徽医科大学第一附属医院)、刘庭波(福建医科大学附属协和医院)、刘耀(重庆市肿瘤医院)、罗军(广西医科大学第一附属医院)、马军(哈尔滨血液病肿瘤研究所)、牛挺(四川大学华西医院)、农卫霞(石河子大学医学院第一附属医院)、钱文斌(浙江大学医学院附属第二医院)、桑威(徐州医科大学附属医院)、施文瑜(南通大学附属医院)、史克倩(云南省第一人民医院)、宋永平(郑州大学第一附属医院)、谭获(广州医科大学附属第五医院)、田裕阳(海南省肿瘤医院)、王季石(贵州医科大学附属医院)、王景文(首都医科大学附属北京同仁医院)、王树叶(哈尔滨医科大学附属第一医院)、王晓波(大连医科大学附属第二医院)、王欣(山东省立医院)、王昭(首都医科大学附属北京友谊医院)、魏征(复旦大学附属中山医院)、徐兵(厦门大学附属第一医院)、徐才刚(四川大学华西医院)、徐卫(江苏省人民医院)、许景艳(南京鼓楼医院)、许彭鹏(上海交通大学医学院附属瑞金医院)、杨申淼(北京大学人民医院)、易红梅(上海交通大学医学院附属瑞金医院)、易树华(中国医学科学院血液病医院)、俞文娟(浙江大学医学院附属第一医院)、袁相贵(浙江大学医学院附属第二医院)、曾庆曙(安徽医科大学第一附属医院)、赵东陆(哈尔滨血液病肿瘤研究所)、赵维莅(上海交通大学医学院附属瑞金医院)、赵谢兰(中南大学湘雅医院)、郑晓云(福建医科大学附属协和医院)、周道斌(中国医学科学院北京协和医院)、周凡(北部战区总医院)、周振海(中山大学附属第一医院)、朱尊民(河南省人民医院)
本文编辑:郎华
