文章信息
东北大学Zhangrun Xu*、Jie Wang , Jiali Xu等在一区期刊《Talanta》上在线发表了题为“Establishment of highly metastatic sublines and insights into telomerase expression during tumor metastasis using a microfluidic system”的期刊文章,文章描述了一种基于细胞侵袭性的差异来筛选高度转移亚系的微流控系统,并研究了癌症转移过程中端粒酶的表达。该研究中转录组测序和数据分析服务由元莘生物提供。

转移是恶性肿瘤的关键特征,复杂的癌症转移过程是癌症相关死亡的主要原因;原发性肿瘤中只有少数细胞亚系可能侵入基底膜并最终转移到远处器官,这种高度转移性细胞的选择和表征对于揭示转移机制、确定新的治疗靶点和筛选抑制转移的抗癌药物至关重要;微流控芯片可以进行高效的细胞筛选,有助于对转移过程进行详细的微观分析端粒酶负责细胞中的端粒延伸,并在维持基因组完整性、细胞增殖和细胞活性方面发挥重要作用;本研究中开发了一种用于研究高度转移性亚系及其亲本细胞中的端粒酶活性的研究方法,旨在阐明端粒酶在肿瘤转移中的作用。研究选择人结直肠癌细胞系LoVo作为研究对应,利用微流控芯片来识别具有高转移潜力的亚系,并通过RNA-seq高通量测序技术对肿瘤转移过程中分子表达变化进行详细分析。
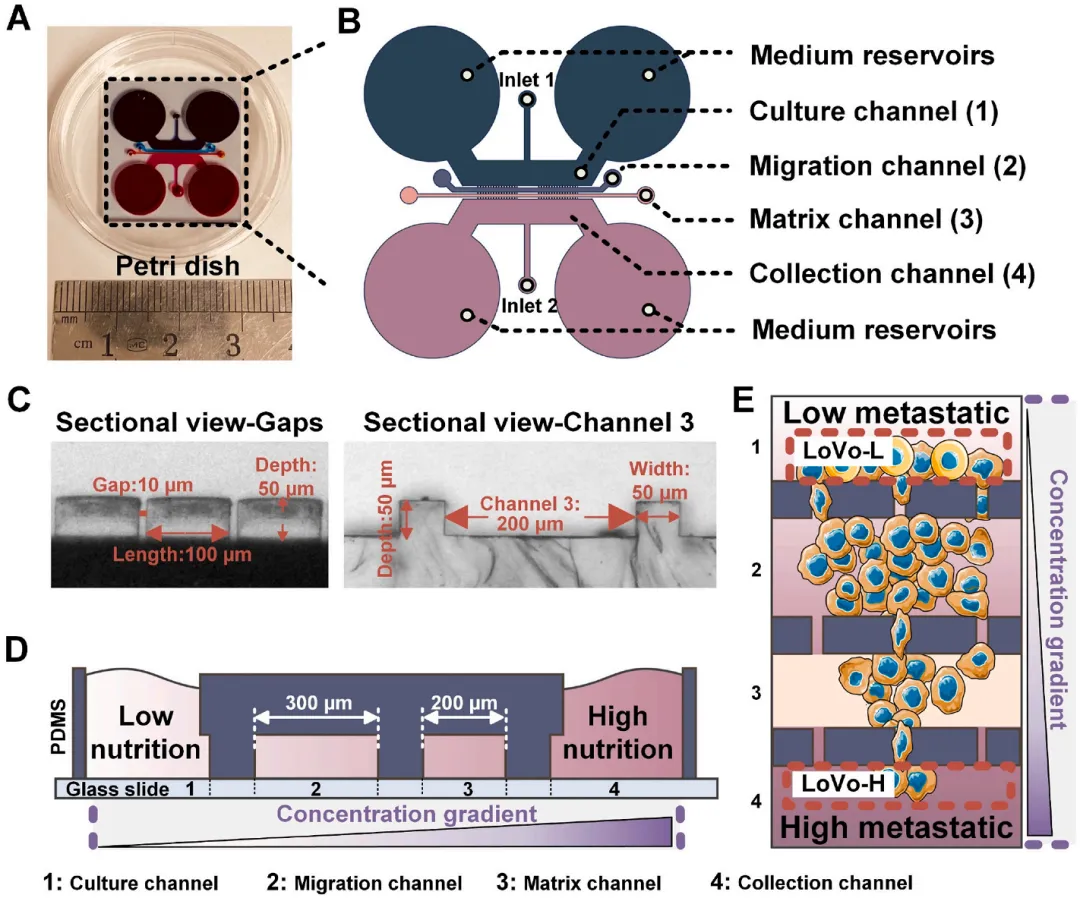
图1 微流控芯片的工作原理
在具有高转移潜能的细胞中,进行端粒酶活性的检测:将LoVo细胞接种到培养通道中,并驱动其沿着胎牛血清梯度迁移。在芯片上筛选高转移亚系细胞,并使用端粒酶检测探针进行端粒酶的荧光成像检测,结果显示细胞迁移能力和端粒酶活性呈正相关。
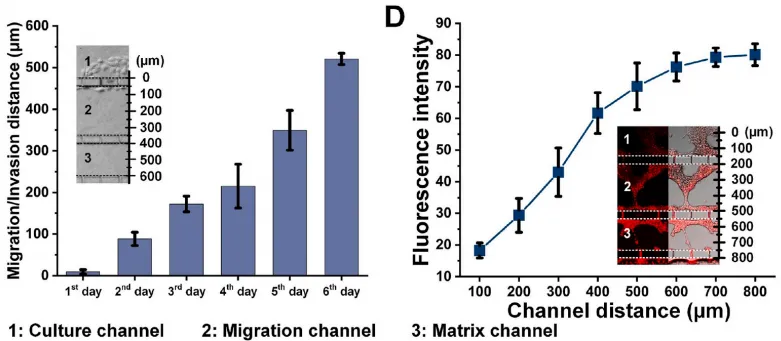
图2 芯片上的细胞迁移能力和端粒酶活性呈正相关
研究定义了第1通道中的细胞,其转移距离最短,转移能力较低,随后被命名为LoVo-L。第4通道的细胞转移距离最长,具有较高的转移能力,命名为LoVo-H。为了评估两个细胞亚系的增殖、迁移和侵袭能力,分别采用了集落形成实验、Transwell侵袭和伤口愈合实验,结果显示LoVo-H具有更强的体外增殖能力和侵袭能力,且LoVo-H亚系细胞表现出更强的恶性肿瘤特征.
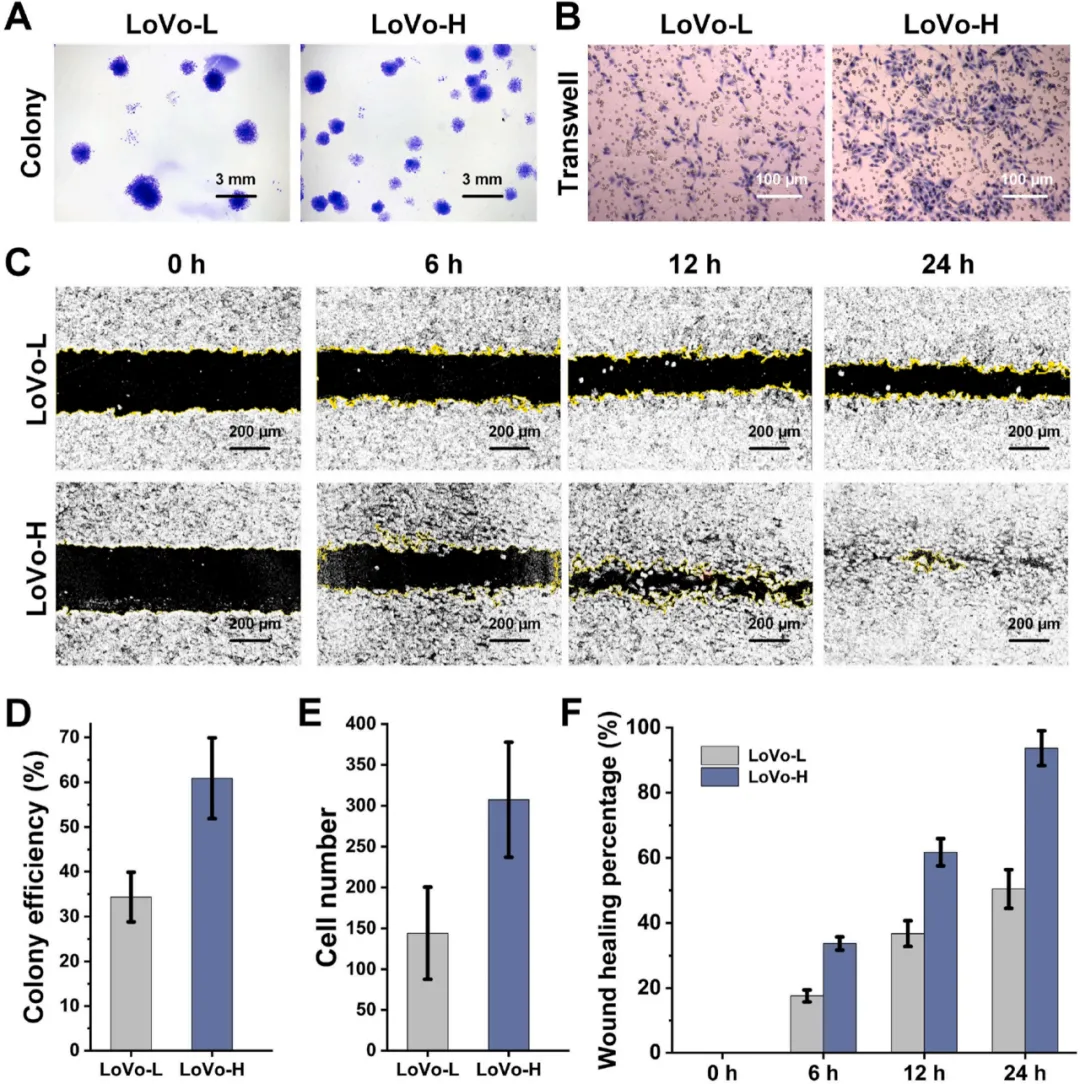
图3 LoVo-L和LoVo-H细胞的特性
研究通过RNA-seq高通量测序技术进一步探讨端粒酶在肿瘤转移中的作用和潜在机制,针对测序数据的进一步生信分析结果显示LoVo-H细胞显示出与端粒酶活性、细胞迁移和上皮-间充质转化(EMT)相关的关键分子的上调;鉴定到的差异基因的GO功能基因集的分析结果显示细胞粘附被显著富集;KEGG通路基因集分析结果显示PI3K-Akt signaling pathway, ECM-receptor interactionand Rap1 signaling pathway等信号通路显著富集;上述转录组数据为揭示肿瘤转移的潜在机制筛选出了有显著特征的分子信息。
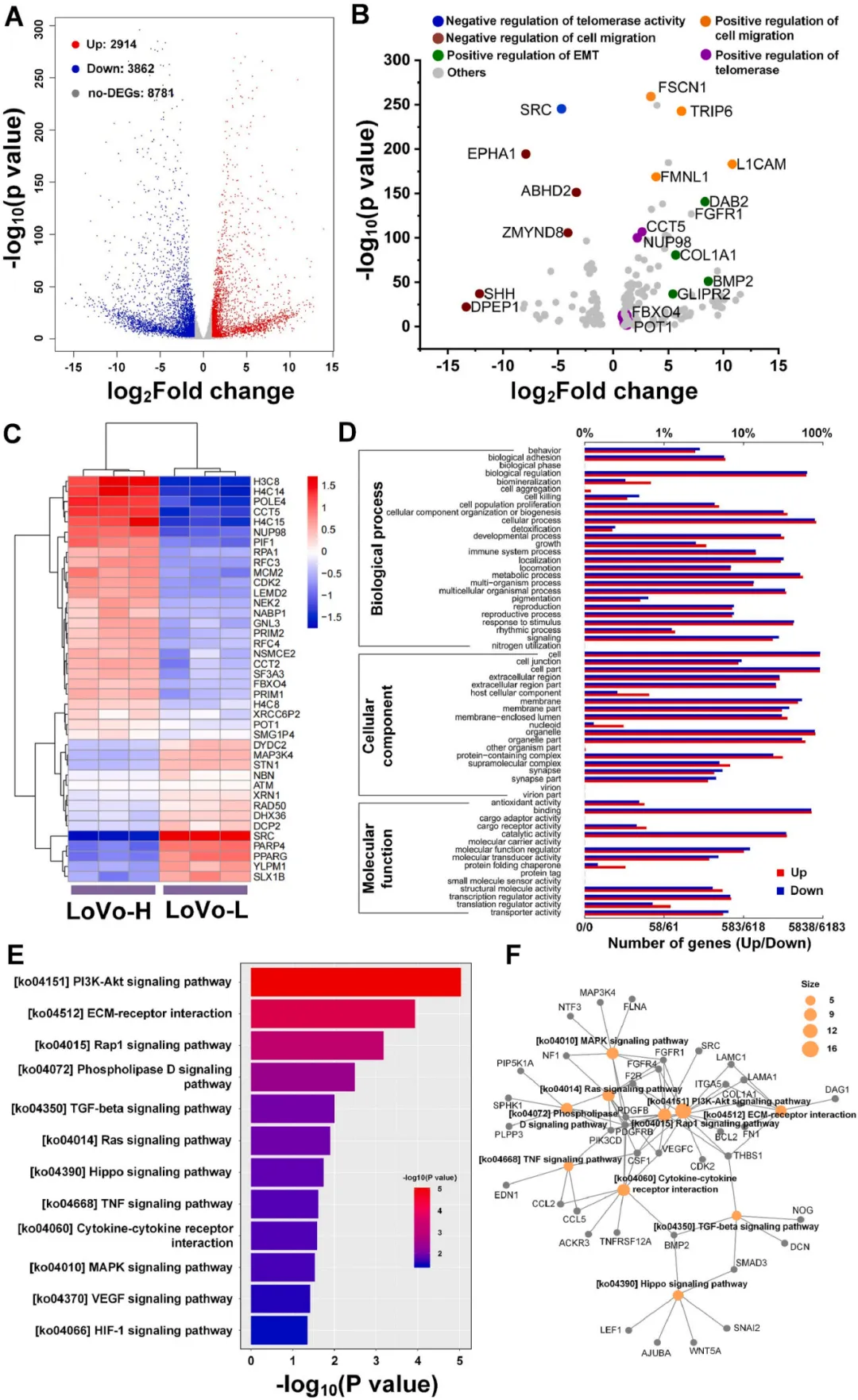
图4 LoVo-H和LoVo-L细胞亚系转录组差异分析
综上,本文论述了高转移亚系及其亲代细胞的端粒酶活性,并阐明了端粒酶在肿瘤转移过程中的作用;研究利用微流控芯片系统,成功分离了一个具有高转移潜能的细胞亚系LoVo-H,后续的集落形成试验、Transwell侵袭试验和伤口愈合分析表明LoVo-H表现出更强的恶性肿瘤特征;通过端粒酶原位荧光探针检测观察到了高转移亚系和亲代细胞之间端粒酶活性的显著差异,进一步通过RNA-seq技术在分子水平上说明了端粒酶在肿瘤转移中具有重要的调控作用,后续会进行更精细的研究以解析端粒酶对肿瘤转移调控作用的调控机制。
文献引用
Wang, Jie, et al. “Establishment of Highly Metastatic Sublines and Insights into Telomerase Expression during Tumor Metastasis Using a Microfluidic System.” Talanta, vol. 280, Dec. 2024, p. 126690. DOI.org (Crossref),https://doi.org/10.1016/j.talanta.2024.126690.
