本文来源:中华肝脏病杂志, 2024,32(1) : 3-15.
本文作者:窦晓光 徐小元 南月敏 魏来 韩涛 茅益民 韩英 任红 贾继东 庄辉
2023年在肝脏疾病各研究领域都有重大进展,现就病毒性肝炎、肝纤维化和肝硬化、肝细胞癌(hepatocellular carcinoma,HCC)、肝衰竭和人工肝、代谢性(脂肪性)肝病、药物性肝损伤(drug-induced liver injury,DILI)及自身免疫性肝病(autoimmune liver disease,ALD)等领域研究进展进行简要介绍。
一、病毒性肝炎临床相关主要研究进展
2023年,距世界卫生组织(World Health Organization,WHO)"2030消除病毒性肝炎公共危害"的目标越来越近了。为了实现这个目标,国内外关于病毒性肝炎方面的研究主要聚焦在疫苗预防作用和如何进行筛查发现感染者,同时更加关注早期诊断和早期治疗,以及抗病毒治疗新药的临床研发。
1.全人群乙型肝炎病毒(hepatitis B virus,HBV)感染筛查实现早期诊断和及时治疗:
HBV感染仍然是严重危害人类健康的公共健康问题。2019年全球HBV相关肝硬化死亡病例高达331 000人,HCC患者更是高达192 000例。主要的原因是感染者没有得到及时诊断和治疗。Polaris 2023年12月15日报告数据:全球乙型肝炎诊断率仅14%,治疗率仅8%,诊断率和治疗率均非常低。
2023年《中华肝脏病杂志》和Journal of Clinical and Translational Hepatology发布了我国《慢性乙型肝炎防治指南(2022版)》,得到了国内外特别是WHO的好评。指南重点强调一般人群HBV感染筛查及应用灵敏的方法检测HBV DNA,并积极推荐扩大抗病毒治疗人群,使更多的慢性HBV感染者符合抗病毒治疗指征。相信经过这些措施的实施,才能实现消除CHB的目标。
同样,美国的Lok教授也在Lancet上发表综述强调应筛查HBsAg及HBV DNA,以明确诊断并指导治疗。除了新生儿全部接种乙型肝炎疫苗(乙肝疫苗)外,对成人接种乙肝疫苗可显著降低成人乙型肝炎发病率,符合成本效益。此外,她还强调尽管目前临床应用的聚乙二醇干扰素(polyethylene glycol interferon, PEG-IFN)α和核苷(酸)类似物[nucleos(t)ide analogs,NAs]抗病毒治疗慢性乙型肝炎,可延缓或阻止其进展为肝硬化和HCC,但不能在短期内彻底清除病毒和HBsAg。因此,对于肝炎活动或疾病进展的患者应该积极抗病毒治疗。
2.慢性乙型肝炎治疗新药及治疗策略:
在2023年的欧洲肝病学会(European Association for the Study of the Liver,EASL)年会和美国肝病学会(American Association for the Study of Liver Diseases,AASLD)年会上,报告了很多II或III期治疗慢性乙型肝炎(chronic hepatitis B,CHB)新药的临床研究结果,尽管在抑制病毒或降低HBsAg水平上显示不错的疗效,但均很难在短期内使CHB患者达到临床治愈。
目前乙型肝炎新药靶点包括病毒基因(cccDNA和整合DNA)、HBsAg和机体免疫细胞。其中,治疗性疫苗包括蛋白疫苗、核酸疫苗和T细胞表位多肽疫苗等。研究者通过生物技术增强其免疫源性,同时提高机体细胞免疫功能。研究显示可以有效地刺激HBV携带者或CHB患者免疫系统,打破免疫耐受(激活免疫应答),达到抑制和清除病毒的目的。关于小干扰RNA(siRNA)类药物研究较多,如Xalnesiran(RG6346)。它是靶向HBV基因组S区GalNAc结合的双联siRNA,也是全球首个CHB和健康对照临床研究。结果显示,治疗后HBsAg下降明显且持久,还不受HBeAg状态的影响。因其安全性和有效性高,有可能成为CHB功能性治愈的骨干药物。
此外,VIR-2218(siRNA)靶向HBV全部主要转录基因,研究结果显示CHB患者接受治疗后HBsAg下降明显。
然而,单一靶点药物均不能在短期内实现临床治愈,更难以获得彻底治愈(彻底清除cccDNA和整合的DNA)。因此,治愈CHB合理的策略是不同靶点的药物联合治疗,例如NAs或PEG-IFNα,联合siRNA及Toll样受体激动剂等免疫制剂。
总之,控制HBV感染仍然靠全面接种乙肝疫苗、扩大筛查和早期诊断与治疗。我们也期待治愈乙型肝炎新药尽早应用于临床,助力实现WHO 2030消除HBV感染公共卫生危害的目标。
3.消除丙型肝炎策略及其疫苗的研发与应用:
直接抗病毒药物(direct-acting antivirals,DDAs)上市后,95%以上的接受治疗的患者可以在短期内获得治愈,丙型肝炎病毒(hepatitis C virus,HCV)感染相关死亡人数明显下降,给消除丙型肝炎危害提供了很多机遇。但全球仍有80%的HCV感染者没有被诊断,单单靠抗病毒治疗还不能帮助在世界范围内彻底根除HCV感染,因此消除HCV感染还有很多挑战。筛查、转诊及治疗,特别关注高风险人群反复感染至关重要。欧美国家也都提出了消除丙型肝炎计划,以彻底消除HCV感染。
当然要想彻底消除HCV感染,也亟需HCV疫苗来减少疾病负担和预防HCV感染。目前HCV相关疫苗包括mRNA疫苗、重组病毒载体疫苗、多肽疫苗、全病毒疫苗、DNA疫苗、理性设计(创新分子)疫苗、T细胞依赖的重组多肽疫苗等。最近研究提示可诱导中和抗体的HCV非结构蛋白的病毒载体T-细胞疫苗,可能会是未来的候选疫苗。当然诱导中和抗体的疫苗必须包括E1和E2蛋白的抗体。在研究疫苗的同时,也强调丙型肝炎疫苗临床研究设计规范及其相应考核终点,还要确定接种人群、监测项目及安全性评价。
尽管目前已经有很多丙型肝炎疫苗进行了临床研究,但尚无有效的保护性疫苗,主要原因是基因多态性、没有相关免疫组分的小动物模型、缺乏丙型肝炎疫苗接种后检测、没有体外病毒培养的组织细胞,以及没有完全阐明针对HCV感染的免疫应答机制等。
4.甲型和戊型肝炎相关研究:
甲型肝炎和戊型肝炎多为急性自限性肝炎,然而在脆弱人群,包括孕妇、免疫功能低下人群或有基础肝病人群可发生重症、慢性肝炎。甲型肝炎病毒(hepatitis A virus,HAV)感染偶尔可以引起重症肝炎、持续性胆汁淤积或复发性肝炎,并可诱发自身免疫性肝炎。戊型肝炎病毒(hepatitis E virus,HEV)感染少见的临床表现包括肝外疾病、急性肝衰竭和持续病毒血症的慢性HEV感染。尽管目前尚无特效抗HAV的药物,一些小分子药物,如JAK2抑制剂AZD 1480、氯化锌和血红素加氧酶等,体外证实其可以抑制病毒复制。对于HEV感染可以应用利巴韦林和PEG-INFα。
此外,特殊人群慢性HEV感染在增加,是否可以用抗HCV的小分子药物治疗HEV感染,特别是慢性戊型肝炎也是目前探索的问题。有研究发现Sofosbuvir联合利巴韦林,可以抑制慢性戊型肝炎患者病毒复制,但疗效还不理想。
我们还要关注HAV/HEV双重/同时感染的问题。由于HAV和HEV都是单股RNA病毒,又有相同的传播途径,应该关注两者同时感染预后问题。尽管患者的临床表现与单独感染相似,但同时感染的患者可以发生重症肝炎,病死率会明显高于单独感染患者。
5.肝炎病毒多方位快速检测新技术:
甲-戊型病毒性肝炎在基因水平上的精准诊断也是目前临床关注的热点,建立在成簇规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)之上的基因编辑系统测序方法,可以多方位检测各型肝炎病毒的DNA和RNA,检测灵敏度和特异度均高。CRISPR-Cas有可能作为病毒性肝炎潜在的诊断方法。
二、肝纤维化及肝硬化研究进展
自2019年中华医学会肝病学分会在《肝硬化诊治指南》首次采用了肝硬化再代偿的概念及Baveno VII共识提出具体标准后,我国学者首次提出了达到再代偿所需的稳定肝功能好转的具体标准[终末期肝病模型(model for end-stage liver disease,MELD)评分≤10,或白蛋白> 35g/L且总胆红素<34μmol/L和国际标准化比值(international normalized ratio,INR)<1.5]。经过120周抗病毒治疗,56.2%的HBV肝硬化患者可以达到Baveno VII共识定义的再代偿标准;立即开始抗HBV治疗的失代偿期肝硬化患者中约有40%在6年抗病毒治疗期间保持稳定的再代偿。此外,有研究发现2年无并发症可以预测稳定的再代偿。
诊断肝硬化时需与恶性肿瘤(特别是有肝转移等情况下)所导致的假性肝硬化(psuedocirrhosis)相鉴别,其特点是有乳腺癌、结肠癌、胰腺癌等肝转移,多有化疗史,有肝脏包膜不光滑、肝实质弥漫性结节样、尾叶增大和门静脉增宽、脾大和侧支循环形成,临床可有消化道出血、肝性脑病等征象,但病理组织学上只有结节性再生而无明显肝纤维化。
在门静脉高压并发症的评估方面,我国多中心研究验证了Baveno VII共识中提出的采用脾硬度测量值(≤40 kPa)排除高危静脉曲张(high-risk varices,HRV)的良好价值。
治疗方面,既要重视病因治疗,也关注其他治疗,如抗纤维化、非选择性β受体阻滞剂(non selective β receptor blocker,NSBBs)、补充白蛋白、出凝血管理等。病因治疗获益的证据进一步丰富:有效的抗HBV治疗不仅改善乙型肝炎伴进展期肝纤维化(Ishak分期≥4)患者的纤维化,还可以促进肝小叶结构的恢复。我国学者研究发现,抗纤维化治疗不仅可改善肝纤维化,而且还可改善临床硬终点:慢性HBV感染伴Ishak纤维化≥3分者在抗病毒治疗的基础上联用抗纤维化药物,可进一步降低HCC风险和肝病相关死亡。亚油酸代谢等通路的多个代谢产物与抗纤维化治疗应答相关。
卡维地洛可降低肝硬化失代偿的风险,可用于静脉曲张出血的一级预防和二级预防。我国学者率先开展的前瞻性随机对照临床试验显示,在NAs抗病毒治疗基础上联用卡维地洛,可更有效延缓出血风险较高的代偿期HBV肝硬化患者食管静脉曲张的进展。白蛋白是治疗肝硬化腹水、自发性细菌性腹膜炎及肝肾综合征等并发症的重要药物,不仅要关注其数量,也要关注其质量(结构和功能)。有研究认为,有效白蛋白(effective albumin,eAlb)(就结合特性而言)主要由结合的配体决定。国外研究发现,eAlb水平比总白蛋白水平能更好地预测肝硬化急性失代偿患者的预后,有望成为肝硬化进展及慢加急性肝衰竭的预后新指标。
荟萃分析提示利福昔明可改善肝性脑病患者的生活质量,凸显其在肝性脑病预防中的价值。
此外,大数据工具和数字医疗也将在肝硬化管理中发挥重要作用。
三、HCC研究及临床进展
HCC的监测及预防仍是提高肝癌早期诊断率及改善生存率的重要策略。国家癌症中心2017—2021年开展多中心、前瞻性慢性HBV感染人群HCC早筛早诊研究,采用超声联合甲胎蛋白(alpha-fetoprotein,AFP)筛查HCC,每年1次,确诊HCC 327例,其中,首轮筛查确诊144例,检出率1.0%,其中早期HCC(eHCC,I~II期)80%;2~4轮筛出率0.5%~0.6%,eHCC达90.9%~95.2%。侯金林教授团队在age-Male-ALBI-Platelets(aMAP)基础上,进一步联合ctDNA构建aMAP-2、aMAP-2 Plus系列HCC预警积分系统,指导HCC个体化精准筛查。美国Fu等报道,同源异形盒A1、C-型凝集素域家族11A、抑癌基因TSPYL5及睾丸特异性Y样蛋白5甲基化可鉴别HCC、肝炎、肝硬化及良性肿物,可作为非肝硬化早期肝癌的早期诊断标志物。Lin等根据HBV感染状况对未抗病毒治疗HBeAg阴性、丙氨酸转氨酶(alanine transaminase,ALT)<40 IU/ml CHB人群,根据HBV DNA载量(<2 000 IU/ml、2 000~20 000 IU/ml、>20 000 IU/ml)、HBV核心相关抗原(HBV core associated antigen,HBcrAg)(<10 kU/ml、> 10 kU/ml)及HBsAg水平(> 1 000 IU/ml、<1 000 IU/ml)将HCC风险分为低危、中危及高危人群,年发病率依次为0.08%、0.18%及0.78%。
随着放射治疗技术的发展,立体定向放疗(stereotactic body radiation therapy,SBRT)已成为早期肝癌根治性治疗方法之一,韩国肝癌协会和国家癌症中心(Korean Liver Cancer Association-National Cancer Center,KLCA-NCC)联合美国放射肿瘤学会(American College of Radiation Oncology,ASTRO)发布国际临床实践指南,推荐SBRT作为Child-Pugh A~B(≤CP-B7)HCC的根治性方案。中华医学会肝病学分会Consensus on the tertiary prevention of primary liver cancer发表于Hepatology International,根据IMbrave050研究,阿替利珠单抗联合贝伐珠单抗与主动监测比较,平均随访17.4个月,HCC复发率降低28%,据此建议对于获得根治性治疗HCC具高复发风险的人群可考虑联合应用抗血管生成靶向药物及免疫检查点抑制剂抗复发治疗。随机、开放、国际多中心3期临床研究(CARES-310)对比观察卡瑞丽珠单抗联合阿帕替尼与单用索拉非尼临床效果,无进展生存期(progression-free survival,PFS)分别为5.6个月和3.7个月,风险比(hazard ratio,HR)0.52,总生存期(overall survival,OS)分别为22.1个月比15.2个月,HR 0.62,P值均<0.000 1,由此该联合方案被纳入国际肝胆胰协会中国分会、中华医学会外科学分会肝脏外科学组及中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)肝癌专家委员会联合制定的《肝细胞癌免疫联合治疗多学科中国专家共识(2023版)》,作为不可切除HCC的一线治疗方案。
中国专家联合研究发现,用去乙酰化酶SIRT2抑制剂(AGK2)或阿司匹林治疗,可促进纤维蛋白原相关蛋白1(fibrinogen like protein 1,FGL1)乙酰化及其蛋白酶体降解,增强细胞程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1)阻断效果,促进T细胞活化和针对肝癌细胞的细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)活性,提高HCC免疫治疗效果;SIRT2水平与乙酰基k98 FGL1水平呈负相关,可预测HCC预后。Ji等对65种肝脏肿瘤类器官(LICOB)组织进行基因组(体细胞突变和拷贝数变异)、表观基因组(DNA甲基化)、转录组、蛋白质组多组学分析,并根据分子分型将LICOB分为4个亚型:肝内胆管癌(ICC)主导型(L-ICC)、增殖主导型(L-PL)、脂质代谢途径主导型(L-LM)、药物代谢途径主导型(L-DM),其中,L-DM亚型,戊糖磷酸途径中葡萄糖-6-磷酸脱氢酶(glucose 6-phosphate dehydrogenase,G6PD)显著升高,敲低G6PD基因/使用G6PD抑制剂能够减少还原型烟酰胺腺嘌呤二核苷酸磷酶(reduced nicotinamide adenine dinucleotide phosphate,NADPH)和谷胱甘肽(glutathione,GSH)等代谢物生成,致氧化还原稳态失调进而抑制L-DM亚型类器官的生长,提示靶向调节G6PD具有临床治疗价值;此外,LICOB预测结果与临床信息、潜在药物响应机制之间具有良好相关性,药物蛋白质组学数据预测仑伐替尼与mTOR抑制剂替西罗莫司具有协同治疗效果。Wang等选择临床病例、患者来源的肿瘤类器官和异种移植物,采用RNA测序鉴定Frizzled10(FZD10)在肝内癌干细胞(cancer stem cells, CSCs)表达,体外、体内实验评估FZD10对CSCs扩增和仑伐替尼耐药性的影响及其机制,证实FZD10表达升高促进肝CSCs扩增和仑伐替尼耐药性,FZD10通过激活β-连环蛋白和YAP1促进肝CSCs自我更新、致瘤性和转移,FZD10/β-连环蛋白/c-Jun/MEK/ERK轴决定了肝癌细胞对仑伐替尼治疗的反应,靶向FZD10的腺相关病毒或β-连环蛋白抑制剂治疗仑伐替尼耐药HCC恢复了仑伐替尼应答,由此得出结论:FZD10可作为HCC新型预后生物标志物和治疗靶点。Hu等报道,高尔基蛋白73(Golgi protein 73, GP73)可调节波形蛋白(Vimentin)的聚合反应,sGP73水平可作为Vimentin高表达HCC的诊断标志,氯米帕明可靶向调节Vimentin,有望作为高sGP73水平HCC并发转移患者的治疗药物。
四、代谢性肝病研究进展
2023年,代谢性肝病领域出现了几项里程碑式的事件或研究结果,将对这个领域的发展产生深远影响。
首先是疾病名称的更新。2021年,AASLD、EASL和拉丁美洲肝病学会(Asociación Latinoamericana para el Estudio del Hígado,ALEH)等肝脏、消化和病理学会以及患者组织共同成立了工作组,经历多轮调查和线上线下会议讨论和投票,将使用多年的非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)更名为代谢功能障碍相关脂肪性肝病(metabolic dysfunction associated steatotic liver disease,MASLD),将非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)变更为代谢功能障碍相关性脂肪性肝炎(metabolic dysfunction associated steatohepatitis,MASH)。此外,还有代谢和酒精相关脂肪变性肝病(MetALD)、酒精相关性肝病(ALD)、特定病因SLD、隐源性SLD和MetALD之外的其他组合(图1)。
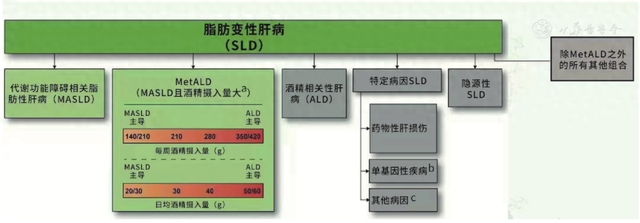
注:MetALD:代谢和酒精相关脂肪变性肝病;a:女性为140~350 g/周,男性为210~420 g/周(日均摄入量:女性为20~50 g,男性为30~60 g);b:例如,溶酶体酸性脂肪酶缺乏症,Wilson病,低β脂蛋白血症,先天性代谢缺陷;c:例如丙型肝炎病毒感染,营养不良,乳糜泻
▲图1 代谢性肝病的命名和定义
根据这一建议,MASLD将取代过去的NAFLD,其定义为存在肝脏脂肪变性且具有5种心血管代谢风险因素中至少一种。需要注意的是,在应用MASLD诊断标准之前,必须排查肝脂肪变性的其他原因,以确保不会遗漏双重甚至多重病因,详见图2。

注:MetALD:代谢和酒精相关脂肪变性肝病;SLD:脂肪变性肝病;ALD:酒精相关性肝病;DILI:药物性肝损伤;BMI:体质量指数;HbA1C:糖化血红蛋白
▲图2 代谢性肝病的诊断流程
此外,对于存在肝脂肪变性,但没有明确的代谢指标异常和未能发现已知病因的患者,采用"隐源性脂肪性肝病"(cryptogenic steatotic liver disease)命名。
在2023年10月召开的美国肝病学会年会上,更多利益相关方共同针对这一新命名对临床诊疗、医疗保险、新药研发及评审的可能影响进行了探讨。应该说明的是,这一更名与亚太地区专家所提议的"metabolic dysfunction-associated fatty liver disease(MAFLD)"名称并无实质性区别,而且翻译为中文均为"代谢功能障碍相关脂肪性肝病",但对国际交流和学术发表带来了很大的困扰。
欧美国家在疾病更名中遇到的障碍对中国也有很多的借鉴意义,在中国后续进行疾病名称和诊断标准更新的过程中,也需要进一步考虑对未来临床工作、科研工作以及药物研发等各个方面的影响。
另一个重要进展是resmetirom (甲状腺素受体β激动剂)在非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)合并F2~F3级纤维化患者中进行的3期临床试验MAESTRO-NASH达到主要研究终点,并在2023年的EASL年会上公布了其结果,52周中期分析显示,该药物成为了第一个在3期临床试验中达到有临床意义的肝脏组织学终点的药物,而且多项评估肝脏脂肪变和纤维化的非侵入性指标均显著改善,支持了肝组织学改善的证据。在安全性方面,主要的不良事件是在治疗起始阶段的腹泻和恶心,但多可耐受。在治疗24周时即可观察到与动脉粥样硬化发生有关的血脂和脂蛋白(包括甘油三酯、载脂蛋白B,载脂蛋白CⅢ和脂蛋白a)的显著降低并维持至治疗结束。该研究将继续随访至54个月以评价resmetirom对长期的临床结局的影响,以及组织学改善和临床获益之间的相关性。
NASH患者接受减重手术后的变化也为我们深入理解病理学改变和临床结局之间的相关性提供了帮助。2023年AASLD年会上报告的一项单中心研究对1994—2021年2 940例接受减重手术的患者进行了前瞻性随访(有活检患者的中位随访时间为14.7年)。结果显示:基线时有NASH和显著纤维化(≥F2)的患者的15年生存率显著更低:分别为83.9%对比92.7%;79.8%对比94.0%(P<0.001)。患者术后NASH缓解而纤维化不恶化与更高的15年生存率相关,与基线时没有NASH的患者相似(88.4%对比92.9%,P=0.4 ),显著高于术后仍持续存在NASH的患者(70.8%)。该研究的重要意义在于:提示了NASH患者的纤维化改善主要是在NASH缓解后观察到,NASH缓解是长期生存的一个重要预测因素,这为以NASH缓解作为临床试验主要终点提供了支持。
有关无创性检测(non-invasive tests, NIT)在NASH诊断和预后评估中的作用仍是近些年来本领域研究的热点。国际上成立了多个学术组织如LITMUS、NIMBLE、The Liver Forum和NAIL-NIT等共同致力于开发和验证NAFLD/NASH的无创生物标志物。2023年,LITMUS工作组发表了一篇综述,通过对25项研究的meta分析发现,非侵入性检查(FIB-4、NFS、FibroScan)与活检的肝纤维化分期具有相似的预测临床结局的性能。2021年EASL发布的《使用非侵入性检查评估肝病严重程度和预后的临床实践指南》、2022年美国临床内分泌医师学会(American Association of Clinical Endocrinologists,AACE)和AASLD联合发布的《基层医疗和内分泌科NAFLD诊断和管理临床实践指南》、2023年AASLD发布的《NAFLD诊断和管理临床实践指南》等,均推荐使用基于NIT的诊断和风险评估路径对NAFLD患者进行分层管理。但药物研发监管部门的态度显然更加谨慎,美国食品药品监督管理局(FDA)在2023年9月举办的一场研讨会上,尽管肯定了一些NIT在临床试验患者预筛选和治疗应答评估方面的作用,但认为目前的证据还不足以支持在药物临床试验中使用NIT作为替代结局指标。
流行病学研究显示,糖尿病会增加NASH患者肝纤维化进展和发生肝脏结局的风险,这也造成了在糖尿病患者中某些肝纤维化风险评估工具的效能可能受到影响。NAIL-NIT在今年AASLD年会上报道的一项研究中,合并分析了8项在NASH非肝硬化人群中进行的2期临床试验的筛查数据,以评估血糖控制状态对于NIT水平的影响。6 558例患者中,有2 123例患者进行了肝活检、FIB-4和糖化血红蛋白(HbA1c)测量。结果显示,就每个FIB-4值而言,与HbA1c < 6.5%的患者相比,HbA1c ≥ 6.5%的患者发生晚期纤维化的概率更高。可见,血糖控制会影响FIB-4预测晚期纤维化的性能,这一点值得在临床使用时加以注意。
五、肝衰竭和人工肝领域研究进展
2023年,EASL发布了《慢加急性肝衰竭临床实践指南》,该指南仍然沿用既往EASL-慢性肝衰竭联盟的慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)定义,推荐意见涉及诊断、急性诱发因素、预后评估、是否需要转入ICU、器官支持以及肝移植决策等诸多方面。该指南建议对于ACLF-3级患者应优先列入基于MELD (-Na)评分评估器官分配的肝移植等待名单,也可以考虑在经验丰富的肝移植中心进行活体供肝肝移植,同时也指出亟需制定ACLF-3级患者无效肝移植的标准。尽管该部指南有值得借鉴之处,但由于我国肝衰竭疾病谱与西方国家存在不少差异,对其推荐意见不能完全照搬,临床上需要结合不同病因及肝病基础上发生ACLF的特点进行诊治。
Zhang等利用国内多中心前瞻性研究队列,对1 024例慢性乙型肝炎急性加重患者的血浆进行代谢组分析,发现ACLF患者的血浆代谢组特征发生明显改变,尤其在膜脂代谢、类固醇激素、氧化应激途径和能量代谢方面;通过靶向代谢组验证发现,一些血浆代谢标志物对ACLF的早期预警及预后判断具有较好的价值。Weiss等基于来自欧洲的2个前瞻性多中心研究队列,发现包含反映系统炎症反应、线粒体功能障碍和交感神经系统激活代谢产物的模型比仅基于器官功能障碍的评分能够更好预测ACLF短期病死率。Sharma等发现急性肝衰竭时,白蛋白更容易被氧化和糖基化,并与患者的严重程度和预后密切相关,"白蛋白的生物分子图谱"特征有助于区分出早期死亡或需要紧急肝移植的患者。Verma等研究发现,基于人工智能的决策树可以对ACLF患者的严重程度进行分层,便于及时进行临床决策。
DIALIVE作为一种新型非生物型人工肝装置,能够吸附内毒素及炎症因子,替换功能失调的白蛋白。Agarwal等采用该装置治疗32例酒精相关ACLF,初步的临床试验结果显示其具有较好的安全性,并可改善患者的预后评分以及与病理生理机制相关的生物标志物,且有助于缩短ACLF缓解时间,但与标准治疗组相比,28 d生存率并没有明显改善,未来尚需要更大样本的临床试验进行验证。虽然该研究存在一定的局限性,但在将来ACLF临床试验时如何尽可能保障研究的同质性和均衡性,是值得借鉴并进一步完善的。
近年来,我国不少学者在生物型人工肝研究方面取得一定进展,在前期的大动物实验以及初步的临床试验中显示出良好的前景。如惠利健教授团队通过将人成纤维细胞转分化为可增殖的人源性肝样细胞(human-induced hepatocytes,hiHep),进而实现《药品生产质量管理规范》条件下大规模扩增,构建了以hiHeps为种子细胞的hiHep-BAL生物型人工肝系统,初步应用于治疗7例行扩大肝切除术的患者,发现患者对hiHep生物人工肝治疗耐受性良好,无明显治疗相关的不良反应,且治疗后有伴随着肝功能改善和肝脏再生,炎症因子降低。
六、药物性肝病研究进展
在DILI领域,去年发表了约2 000篇涉及基础和临床的文献,较过去有了明显的增长。2023年,有3部指南/专家共识发布,成为了DILI领域的重要事件。
(一)DILI易感性与机制研究
多项研究报道了特定药物的DILI遗传风险因素。如阿莫西林-克拉维酸肝损伤的发生风险可能与内质网氨肽酶2(endoplasmic reticulum aminopeptidase 2,ERAP2)低表达和HLA-B∗15:18基因型相关,据此建立的遗传风险评分可能有助于其因果关系评估和风险管理。有报道认为HLA DRB1* 11:04可能与硝基呋喃妥因肝损伤的风险相关。
2023年,包括来自国内的多项针对对乙酰氨基酚(acetaminophe,APAP)诱导的肝损伤(AILI)机制的研究成果发表。有研究提出,肠道菌群参与AILI发生,阴道乳杆菌β-半乳糖苷酶可通过释放黄豆苷元抑制法尼酰二磷酸合酶介导的肝细胞铁死亡。肝细胞Mas激活增强了AKT-FOXO1依赖性噬脂和脂肪酸氧化,保护小鼠免受APAP肝毒性影响。人肝细胞核因子(hepatocyte growth factor,HNF)4α可通过与核因子E2相关因子(nuclear factor erythroid-2-related factor 2,Nrf2)相互作用,提高谷胱甘肽水平,促进AILI恢复。此外,一些研究关注免疫细胞的作用,以及肝细胞和免疫细胞间的相互作用。这些研究为进一步阐明AILI/DILI机制,提供潜在的治疗靶点,具有重要意义。
(二)DILI诊断的生物标志物
DILI的诊断和鉴别是药物开发和临床实践中的重大挑战。蛋白质组学研究发现,果糖-1,6-二磷酸酶1(fructose-1, 6-bisphosphatase, FBP1)单独或与谷胱甘肽S转移酶A1和白细胞源性趋化因子2结合使用时可能有助于DILI诊断和鉴别,但这些候选血清生物标志物尚需进一步验证。
(三)指南/专家共识发布
2023年3月,美国肝病学会发布了关于《药物、草药和膳食补充剂引起的肝损伤的实践指导》,尽管作者强调不是指南(guidelines),该指导(guidance)就DILI常见的临床、实验室和组织学特征提供建议,并提供了基于专家意见的患者管理建议。
2023年5月,我国发布了《中国药物性肝损伤诊治指南(2023版)》。新版指南整体的学术观点已与国际接轨,包括急性DILI诊断时的肝脏生物化学阈值和间接型DILI的提出、慢性和特殊表型DILI、专门阐述的慢性肝病基础上的DILI和DILI的常见病因等。同时,指南首次阐述了属于间接型DILI范畴的药物导致的肝炎病毒再激活,并提出了DILI的治疗目标。
2023年9月,《药物诱导的自身免疫样肝炎(DI-ALH)的命名、诊断和管理:专家意见会议报告》正式发表。该国际会议于2022年3月召开,包括我国专家在内的数十位国际专家参与讨论。此国际共识,提供了伴随自身免疫特征DILI患者规范化命名、诊断和管理的指导意见,同时,该共识比较了DI-ALH和自身免疫性肝炎(autoimmune hepatitis,AIH)的临床特征、免疫学、组织学特征、治疗管理等,以指导临床医生更准确认识和治疗DI-ALH。
(四)科学监管降低DILI发生
APAP是固有型DILI的典型代表。发表于JAMA的研究显示,自2011年1月美国FDA宣布规定对乙酰氨基酚与阿片类药物复方制剂的剂量不得超过325mg/片后,美国AILI患者的住院率和急性肝衰竭比例显著下降。这凸显了药品监管部门的科学监管对减少DILI危害的重要性。
七、自身免疫性肝病研究进展
(一)AIH
2023年度AIH的进展主要集中在疾病自然史和特殊AIH人群。一项来自欧洲的研究对117例儿童AIH患者进行了分析,发现1型和2型AIH患者的长期预后并无显著差异。对于仅通过连续转氨酶正常而无肝活检的停药情况,约45%可维持无复发状态,而反复持续的凝血指标异常与早期肝移植风险相关。一项基于1 428例AIH患者长期随访研究发现,仅1.7%的患者会发生HCC,且肝硬化仅轻度地增加了HCC的风险;但肥胖和AIH-原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)重叠是HCC的另外两个高危因素。另一项瑞典的研究发现,患有AIH的孕妇出现早产的风险是对照人群的5倍,但肝硬化并未增加早产的风险。
(二)原发性胆汁性胆管炎(primary biliary cholangitis,PBC)
PBC免疫学发病机制的探索是该领域长期的热点问题。既往GWAS研究的基础上,有研究发现AT-rich interactive domain-containing protein 3A(ARID3A)及其非编码变异体可能与PBC的遗传易感性相关,有研究表明,双氧化酶2(dual oxidase 2,DUOX2)阳性、血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)阳性的小胆管细胞可能是PBC的致病性靶细胞。进一步发现ARID3A可通过影响巨噬细胞对凋亡胆管的胞葬作用,加重PBC的胆管损伤。脯氨酰4-羟化酶α多肽II(prolyl-4-hydroxylase alpha polypeptide II,P4HA2)通过Hippo相关通路调节肝内胆管反应和胆管硬化。
针对PBC,我国学者建立了熊脱氧胆酸(ursodeoxycholic acid,UDCA)治疗1个月后评价应答的新标准[碱性磷酸酶(alkaline phosphatase,ALP)≤2.5×正常值上限(upper limit of normal,ULN),天冬氨酸转氨酶(aspartate transaminase,AST)≤2×ULN,总胆红素(total bilirubin,TBil)≤1×ULN ],并将之命名为"西安标准"。此标准对中高风险人群的评价效能显著优于现有国际标准,对于改善疾病长期预后具有重要的价值。秉承早期强化治疗的理念,我国学者开展的一项随机对照临床研究表明,联合非诺贝特可缩短生化应答时间,并将治疗1年后的生化应答率由64.3%提升至81.4%,将ALP复常率由40%提升至62% 。该研究提示提前加用非诺贝特治疗的起点可能提高患者获益,这一理念也与国际上提出的"ALP正常化"这一强化管理指标相一致,未来将有可能改变现有临床治疗路径。
一项基于公共数据库和队列验证的研究发现,高风险PBC患者的外周血中硫氧还蛋白互作蛋白(thioredoxin interacting protein,TXNIP)、CD44及外核苷三磷酸二磷酸水解酶1(ectonucleoside triphosphate diphosphohydrolase 1,ENTPD1)基因表达显著上调,三者联合应用可准确识别高风险患者。此外,PBC患者存在肠道菌群的特征性变化,且与患者疾病状态、胆汁酸代谢、UDCA应答情况密切相关,有可能成为无创诊断和风险评估标志物。
肝脏纤维化和肝硬化是PBC疾病进展和出现不良事件的高危因素,基于肝硬度的风险分层方法具有重要的临床指导意义。最新的研究发现,Baveno Ⅶ共识中提出的5 kPa肝硬度分级方法(10 kPa-15 kPa-20 kPa)也适用于PBC患者,且临床肝脏硬度的显著变化与疾病进展风险显著正相关,可以准确提示疾病进展风险。
PBC的新型治疗药物研发也是目前的热点。现阶段,多数新药均是围绕过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)进行设计,已有多个药物进入了临床Ⅱ期或Ⅲ期临床研究阶段,且显示出了良好的治疗效果。
一项3期临床试验显示,PPAR-α/δ激动剂Elafibranor联合UDCA可改善血生化和瘙痒症状。PPARδ激动剂seladelpar 3期临床试验显示,可改善生化;2年开放研究证实了其生化改善效果。PPARα/γ激动剂saroglitazar联合UDCA 2期临床试验显示可改善生化,但转氨酶升高等不良反应发生率较高。还原型辅酶I氧化酶1/4抑制剂setanaxib 2期临床试验显示,可改善生化及肝纤维化无创指标。2b期临床试验显示,回肠胆酸转运蛋白抑制剂linerixibat改善PBC患者皮肤瘙痒,但腹泻和腹痛可导致停药。
(三)PSC
一项研究聚焦PSC患者的早期风险分层,构建了基于核磁影像组学和生物化学指标的复合评价模型(胆管直径、TBil、转氨酶),可准确预测患者需进行肝移植或发生死亡的风险,具有重要的临床指导意义。一项来自瑞典的多中心研究表明,采用增强核磁联合糖类抗原199(carbohydrate antigen 199,CA199)初筛,联合经内镜逆行胆胰管成像和活体组织检查,对早期胆管细胞癌的检出效能有限,难以改善发生胆管细胞癌后的总体生存。一项研究创新性探索了靶向致病菌的生物疗法,发现针对肺炎克雷伯菌的噬菌体可显著减轻PSC动物模型中肝内炎症,具有重要的临床转化应用前景。
本文编辑:金生
