作者:黄敏轩 唐攀 岑天天 贾潇天 孙超 金洁 赖宁燕 陈众博 丁群力 陶凤云 马红映
第一作者单位:宁波大学附属第一医院呼吸与危重症医学科 宁波市呼吸疾病研究重点实验室
通信作者:马红映,宁波大学附属第一医院呼吸与危重症医学科 宁波市呼吸疾病研究重点实验室
引用本文: 黄敏轩, 唐攀, 岑天天, 等. 恶性周围神经鞘膜瘤胸膜转移1例 [J] . 中华结核和呼吸杂志, 2024, 47(7) : 658-662. DOI: 10.3760/cma.j.cn112147-20240105-00011.

摘要
恶性周围神经鞘膜瘤(malignant peripheral nerve sheath tumor,MPNST)常转移至肺,胸膜转移罕见。本文报道1例MPNST胸膜转移患者。患者青年男性,因“气促伴干咳1周”就诊。既往恶性周围神经鞘膜瘤病史。内科胸腔镜胸膜活检病理提示短梭形细胞增生,胸膜病理切片免疫组织化学染色S-100(+)、SOX-10(+)、Ki-67(+)阳性指数20%、H3K27Me3(-),诊断为MPNST胸膜转移。
正文
患者男,25岁,因“气促伴干咳”1周于2021年10月6日收入院。患者于1周前在家中无明显诱因下出现气促,呈进行性加重,伴干咳,无胸痛,无夜间阵发性呼吸困难,无咯血,近日出现静息下明显气促,遂就诊,门诊行胸部CT检查可见两侧胸腔大量积液伴双肺部分肺不张(左侧为著),双肺渗出性改变(图1)。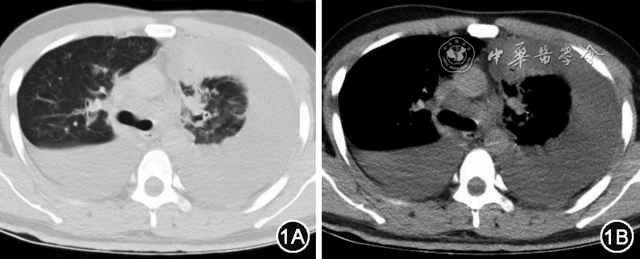


图3 胸膜冷冻活检病理图像,其中图3A可见梭形细胞弥漫分布、异形性大,胞质丰富 HE染色 高倍放大;图3B为免疫组织化学染色示SOX-10强阳性(+++)高倍放大;图3C为免疫组织化学染色示Syn阳性(++)高倍放大;图3D为免疫组织化学染色示Ki-67(+)阳性指数50% 高倍放大;图3E为免疫组织化学示INI1强阳性(+++)高倍放大;图3F为免疫组织化学染色示H3K27Me3阴性(-)高倍放大;图3G为免疫组织化学染色示Desmin阳性(+)高倍放大;图3H为免疫组织化学染色示CD56强阳性(+++)高倍放大
图4 胸膜活检病理图像,其中图4A具有明显的短梭形细胞,异形性大,胞质丰富 HE染色 高倍放大;图4B为免疫组织化学检查示肿瘤细胞SOX-10强阳性(+++)高倍放大;图4C为免疫组织化学检查示肿瘤细胞S-100阳性(+)高倍放大;图4D为免疫组织化学检查示肿瘤细胞Ki-67(+)阳性指数20% 高倍放大;图4E为免疫组织化学检查示肿瘤细胞H3K27Me3(-)高倍放大
讨论
恶性周围神经鞘膜瘤(malignant peripheral nerve sheath tumor,MPNST)是指任何起源于外周神经或神经鞘分化,除外源自神经外膜或周围神经血管的恶性肿瘤[1]。MPNST局部复发率高、远处转移率高,约占所有软组织肉瘤的5%~10%[2]。恶性蝾螈瘤(malignant triton tumor,MTT)是MPNST的一种亚型,表现为横纹肌母细胞分化,占所有MPNST的5%[3]。MPNST在健康人群中的发病率约为0.001%,50%的MPNST发生在Ⅰ型神经纤维瘤病(neurofibromatosis type 1,NF1)患者中。在其余病例中,45 %的MPNST发生于散发病例且基因不明,其余均与放疗相关[4, 5]。既往有NF1病史或者一级亲属中有NF1病史可协助诊断。NF1患者的MPNST发生年龄明显小于散发性MPNST[6]。散发性MPNST发病年龄通常为20~50岁,没有性别差异[7]。MPNST最常见的发生部位是四肢(40%),其次是躯干(22%),头颈部(20%)和腹膜后内脏区域(15%)[8]。发生在胸腔少见。MPNST远处转移的发生率为14.3%,肺(58.7%)转移最常见,其次是骨(35.8%)、肝(17.4%)和脑(3.7%)[4]。发生胸膜转移罕见。在发病早期,患者常无明显临床表现。MPNST主要表现为逐渐增大的肿块及其引起的神经症状。MRI和PET-CT是评估神经鞘瘤的重要成像方式。氟标记脱氧葡萄糖(18F-labeleddeoxyglucose,FDG)PET还有助于区分高级别MPNST和良性丛状神经纤维瘤[8]。MPNST的诊断主要依靠组织病理检查,没有特异的分子或免疫组化标志物[1]。大体表现上,MPNST表现为附着的外生性肿块[9]。切面呈灰白实性,常伴局部出血、坏死。很难通过细针活检或其他细胞学诊断MPNST[10]。显微镜下,MPNST通常是高级别肉瘤,具有紧密排列的梭形细胞[9,11]。其核染色质丰富、深染,核型不规则、不对称,呈伸长弯曲的波浪状,有丝分裂象多见。胞质多呈淡嗜伊红色或双色性。免疫组化中,大多数MPNST在所有神经鞘染色中均为阴性,仅在一小部分肿瘤细胞中S-100蛋白和(或)SOX-10呈阳性。少数MPNST保持了施旺细胞表型,具有广泛的S-100蛋白和SOX-10阳性[12]。S-100蛋白是用于鉴定各种神经鞘肿瘤的最常用抗体,但通常只有50%~70%的MPNST显示出S-100染色阳性[13]。S-100蛋白阴性状态预示着较低的生存率和较高的复发率[1]。Ki-67标记指数也有助于评估NF1患者的神经鞘瘤,普通的神经纤维瘤和非典型的神经纤维瘤通常具有低标记指数(<2%~5%),较高的增殖率(>10%)可能有助于检测神经纤维瘤中的MPNST[12]。Ki-67标记指数的增加是MPNST预后不良的强预测因子[2]。神经纤维瘤中 CD34 阳性成纤维细胞网络的缺失也可作为诊断 MPNST 的有用线索。然而,一些MPNST保留了CD34阳性的成纤维细胞样元素[12]。近年来发现组蛋白H3第27位赖氨酸三甲基(trimethylated histone H3 at lysine 27,H3K27me3)表达缺失对于 MPNST 的诊断具有相对特异性[2]。相较于NF1相关性MPNST(60 %),多数散发性(95%)和放射治疗相关性(91%)MPNST 均显示H3K27me3 基因表达缺失[14]。结蛋白 Desmin、myoD1和肌原蛋白Myogenin 阳性是横纹肌细胞分化的标志[3]。本例患者血清、胸腔积液中CA-125、NSE明显升高,胸腔积液中CA-125的水平明显高于血清,胸腔积液/血清高比值表明肿瘤标志物CA-125是由胸腔产生的,而不是从血清中被动扩散的[15]。由于CA-125通过胸膜、心包和腹膜的浆膜间皮细胞表达,当这些结构发生炎症时,CA-125的分泌会增加[16]。患者双侧大量胸腔积液,可能在一定程度上解释了CA-125的明显升高。NSE是一种糖酵解烯醇化酶,由神经内分泌细胞和神经源性肿瘤分泌[17]。同时,胸腔积液中CYFRA 21-1也升高。CYFRA 21-1的水平可能反映了恶性细胞中细胞骨架的形成,当上皮细胞转化为癌细胞时,角蛋白含量会增加。由于恶性细胞坏死或凋亡,caspase-3蛋白活性增加,CYFRA 21-1 的可溶性片段被释放到胸腔积液中[18]。另一方面,胸腔积液 CYFRA 21-1 含量高可能是淋巴回流受阻或肿瘤累及胸膜所致。恶性胸腔积液通常是单侧的,双侧胸腔积液发生率为10%~13%[19]。内科胸腔镜下胸膜活检组织病理是诊断不明原因胸腔积液的“金标准”[20]。诊断为恶性胸腔积液的中位生存期为3~12个月[19]。MPNST通常通过神经周围直接侵犯或血行转移[21]。肺部是MPNST最常见的远处转移部位。淋巴转移并不常见,主要与广泛转移同时出现,发生率不到10%。肉瘤转移到肺部常为孤立性结节,本例患者出现肺部多发结节,可能为血行转移引起。本例患者术后病理提示高级别MPNST伴部分横纹肌样分化(MTT),与MPNST相比,其生物学行为更具攻击性,预后更差,MTT的5年生存率仅为3%~10%[3]。目前,MPNST尚没有标准化的治疗方案。积极行广泛扩大切除术是最重要的[13]。MPNST 患者的生存率主要取决于切除范围[22]。因此,如果可行并为患者所接受,建议进行R0切除,达到组织切缘阴性[22]。然而,手术的范围必须保持平衡,以保留神经功能[22]。此外,只有当肿瘤直径<5 cm时,手术才能提高总生存率[16]。许多肿瘤因其位置较深或体积较大,而无法切除或者不能完全切除[23]。MPNST局部复发率、全身转移率高,无论手术切除的范围如何,都应考虑辅助治疗。由于缺乏明确数据,采用辅助放疗或化疗的方式和时机仍存在争议[22]。对于肿瘤体积较大无法切除的病例,应积极考虑术前放疗,以提高手术切除的可能性[22]。术后辅助放疗被认为有改善局部控制的趋势,但对总生存率无显著影响[22]。然而,对于放疗继发的MPNST不建议行辅助放疗。由于放疗会造成染色体损伤,诱导施旺细胞异常增殖;且周围神经对放疗非常敏感,放疗后持续的炎症反应会导致周围神经微环境变化并产生更高的增殖率;还可能导致淋巴阻塞和神经周围血管的纤维化损伤,从而使突变的施旺细胞逃避免疫监视并继续增殖;尤其是对易感患者而言,放疗会加速恶性神经鞘瘤的进展[24]。据估计从放疗到确诊 MPNST 的平均潜伏期为15~16年[25]。此外,放疗诱导的MPNST更容易在照射部位局部复发[25]。随着分子生物学的发展,靶向治疗引起了广泛关注,其治疗效果更好,不良反应更少。MPNST是一种罕见的侵袭性软组织肿瘤,复发率高、转移率高,发生胸膜转移的MPNST罕见,胸腔镜检查获得胸膜组织病理学有助于该病的诊断。血清和胸腔积液肿瘤标志物可能对于MPNST的监测有一定的临床意义。MPNST早期常无明显临床表现,然而,肿瘤进展迅速且潜伏,放疗被认为能延缓肿瘤复发,但对总生存率无显著影响,积极行广泛扩大切除术是主要治疗手段。参考文献(略)