在亚太肝脏年会上(APASL2023),研究人员介绍了由Replicor公司研发正在2期试验中针对乙肝病毒合并丁肝病毒感染在研新药REP 2139最新数据。

乙肝/丁肝在研新药REP 2139,通过SC,挽救BLV失败及反弹数据
REP 2139阻断乙肝病毒(HBV)亚病毒颗粒的组装和肝炎δ抗原的功能,推动HBV感染中的乙肝表面抗原(HBsAg)丢失和HBV/HDV合并感染中的HBsAg/HDVRNA丢失。研究人员表示,目前正在对Bulevirtide(BLV病毒进入抑制剂,一种丁肝新药)治疗失败或病毒反弹后的慢性HBV/HDV合并感染的肝硬化受试者采用皮下注射(SC)REP 2139-Mg组合疗法评价安全性和有效性。
本研究指,通过SC REP 2139-Mg以挽救,过往选择Bulevirtide失败或病毒反弹的HBV/HDV感染肝硬化受试者案例。8名代偿期肝硬化受试者在接受2或10毫克剂量的Bulevirtide治疗期间无反应或HDVRNA病毒逃逸,因此,法国药品安全局(ANSM)批准了REP 2139-Mg的同期准入。
以现有已获批抗病毒药物富马酸替诺福韦二吡呋酯(TDF)辅以48周的QW SC 250毫克REP 2139-Mg和90或180 μg pegIFN。每周进行安全评估,每4周进行一次病毒学评估。

在本摘要提交时,已有5名受试者至少接触了4周的REP 2139-Mg。1名受试者完成治疗后,HDVRNA在第4周清除,HBsAg在第12周清除并血清转换,在第9周出现无症状的转氨酶自解。移除REP 2139-Mg和pegIFN 5个月后,HDVRNA和HBsAg仍然检测不到,HBsAg血清转换(348 mIU/ml)。
在1名受试者中,观察到中心性肥胖(内脏型肥胖)可能阻止了REP 2139的最佳肝脏积累,目前HDVRNA和HBsAg分别较基线下降了 2.2 log 10 IU/mL和 0.7 log 10 IU/mL。该受试者的REP 2139-Mg给药随后过渡到静脉输注。
2名有大量REP 2139-Mg暴露的受试者在第13周和第16周经历了HDVRNA清除,HBsAg丢失(第16周),第一名受试者的HBsAg血清转换(现在是934.4 mIU/mL)。第二名受试者的HBsAg水平下降>2 log 10 IU/mL。第5名受试者在第4周出现了HDVRNA下降0.5 log 10 IU/mL。到目前为止,采用皮下注射250毫克REP 2139-Mg与口服TDF和pegIFN的给药耐受性良好。
研究结论:在代偿期肝硬化受试者中,皮下注射REP 2139-Mg+TDF+小剂量pegIFN后,通常具有良好的安全性和耐受性,对HBV和HDV感染有效。REP 2139-Mg也是经治失败受试者(使用Bulevirtide)的有效挽救疗法。
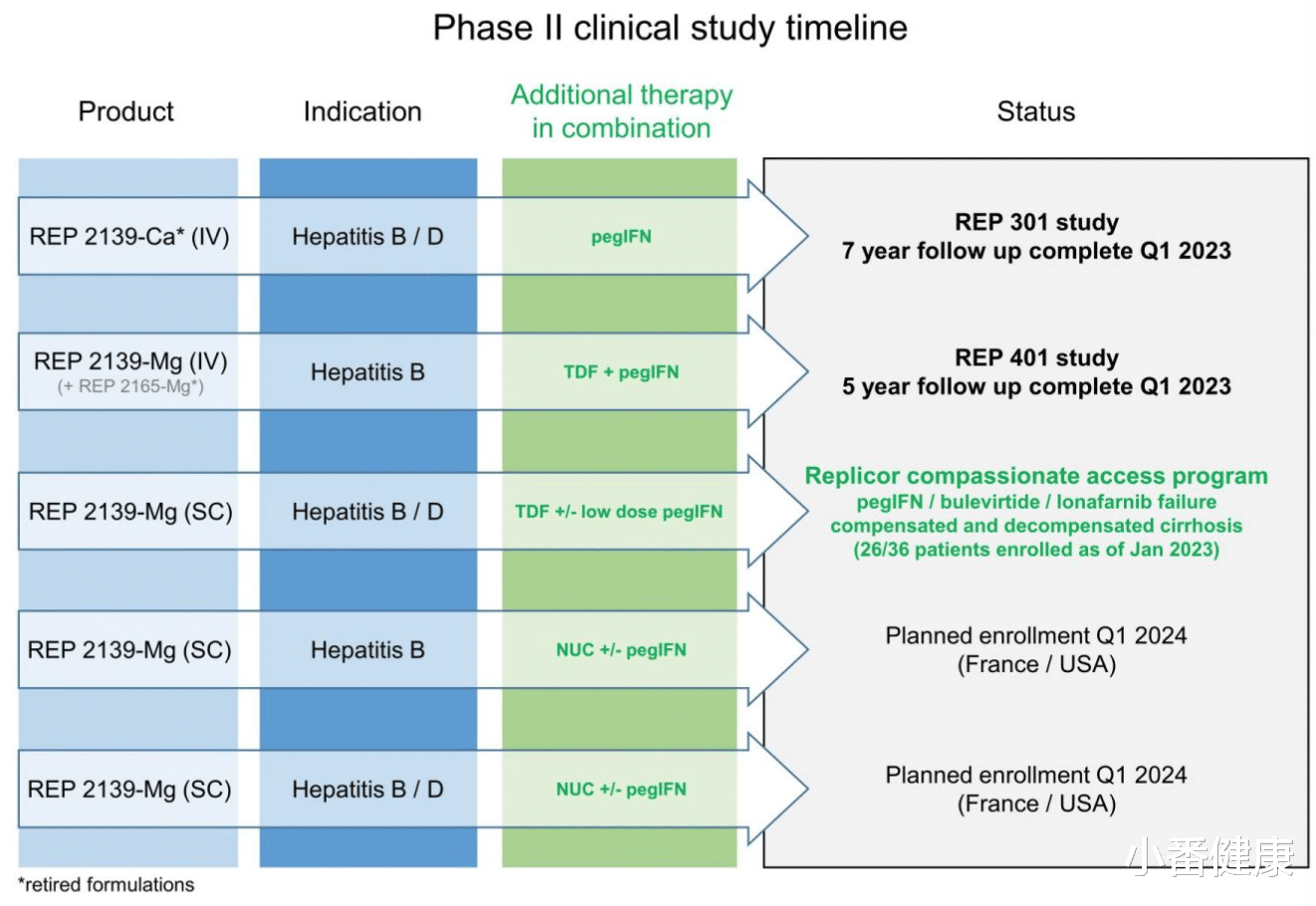
小番健康结语:REP 2139是Replicor公司研发的在研核酸聚合物(NAP),同时正在进行针对HBV、HBV/HDV以及挽救HBV/HDV合并感染肝硬化受试者的临床开发中。当然,近年来REP 2139逐渐转向针对挽救因对丁肝药物和病毒反弹的HBV/HDV感染肝硬化受试者的同情使用。以上是在本届亚太肝脏年会上,与REP 2139开发最新数据。
