血栓形成是在血管内流动着的血液凝固或某些有形成分凝集形成固体块,引起血管部分或完全堵塞,导致相应部位血液供应障碍的病理过程。当这种情况发生时,血栓会阻碍血液流动,或者脱落,去到身体的其它地方。如果血栓卡在肺或大脑等关键部位,就会阻碍流向那个器官的血液,导致危及生命的紧急情况。

血栓可在动脉形成,也可在静脉形成。动脉负责将血液从心脏输送到身体的其它部位,动脉血栓形成是心脏病发作和中风的最常见原因;静脉负责将血液从身体输送回心脏,静脉血栓形成是肺栓塞最常见的原因。
血栓形成极为常见,研究显示全球四分之一的住院患者死亡原因与血栓栓塞有关。血栓形成在患有某些疾病的人群中更为常见,包括房颤、癌症、冠状动脉疾病、糖尿病以及凝血障碍(比如抗磷脂综合征)。
血栓形成可导致许多不同的并发症,这取决于血栓形成或移动的位置:
肺部:肺栓塞大脑:短暂性脑缺血发作或中风心脏(冠状动脉):心脏病发作颈部(颈动脉):短暂性脑缺血发作或中风腹部(肠系膜上动脉或其分支之一):肠系膜缺血血栓形成的原因是什么?
当某些东西破坏血管内壁或减慢血液流动时,就会形成血栓,无论哪种情况,都是血液中的细胞在不应该粘在一起的时候开始粘在一起。
正常情况下,我们血液中的许多细胞和谐共存,并在需要完成某项工作时聚集在一起。例如,如果有伤口,血小板和蛋白质会在受伤部位结合在一起,起到止血的作用。这一过程形成一个必要的血凝块,防止失去太多的血液。伤口愈合后,血块就会溶解。这就像工作中的紧急会议,每个人都挤在一张桌子前,问题解决后,每个人都离开,各奔东西。
但是,各种医学状况、药物和其它因素都可能导致我们的血液成分在不需要的时候聚集在一起,或者在应该溶解的时候不能溶解。
机体要维持体内血液正常的流动状态和防止血液丢失,需要维持凝血和抗凝之间的动态平衡。机体的正常凝血依赖于完整的血管壁结构和功能,有效的血小板质量和数量,正常的血浆凝血因子活性。血小板和凝血因子是生理性凝血的重要成分。组织因子是唯一不存在于正常人血浆中的凝血因子,它存在于血管内皮细胞、单核细胞、巨噬细胞上。炎症和感染等可促使组织因子合成和表达,并可释放到血浆中。各种原因引起组织因子活性的升高将会导致血管内血栓形成,从而引发多种疾病。组织因子不仅参与血栓形成的始动过程, 而且还参与血栓的不断增大以及血栓形成的整个过程。血液循环中的组织因子不断覆盖在血栓表面, 反复启动凝血, 最终使血栓不断增加。抗凝系统对凝血过程进行负调节,人体最主要的抗凝系统包括组织因子途径抑制物。凝血和抗凝之间的失衡可能导致血栓形成。

血栓形成是血小板粘附在血管内皮损伤后裸露的胶原表面,粘附的血小板会释放出二磷酸腺苷和血栓素A2等物质促使更多的血小板粘附、聚集形成血小板血栓,形成血栓头部;血管内皮的损伤也会激活内源性和外源性凝血系统,在血小板小梁之间的血液发生凝固,纤维蛋白形成网状结构,网内充满大量的红细胞,形成血栓体部;最后局部血流停止、血液凝固,形成血栓尾部。
血栓形成的机制很复杂,是遗传和环境危险因素共同作用的结果。因此,迫切需要确定可改变的危险因素,以预防血栓形成事件,进而预防不良的长期结果。肠道菌群在人类健康的各个方面发挥重要作用,从而对宿主生理产生重要影响。肠道菌群是许多慢性疾病的可改变的宿主因素。各种环境或遗传因素对肠道菌群的干扰会导致血管内皮细胞、血小板和先天免疫细胞中炎症通路的激活,从而释放各种凝血蛋白,导致促血栓形成的状态。
肠道菌群诱导血栓形成的机制
1、代谢物产生
肠道菌群诱导血栓形成的一种机制是通过肠道菌群产生的代谢物。肠道微生物可以利用饮食中的成分,并能改变宿主体内代谢物的产生。
肠道细菌会将胆碱、肉碱和磷脂酰胆碱等营养物质代谢为三甲胺,然后三甲胺会在肝脏被氧化为氧化三甲胺。氧化三甲胺一旦进入体循环,会导致血小板高反应性,并在动脉粥样硬化的早期阶段增加泡沫细胞的沉积。西式饮食富含这些营养物质,会促进肠道中增加三甲胺产生的微生物的富集。较高的血浆氧化三甲胺水平与心血管疾病和血栓形成事件的不良结局有关。
血浆氧化三甲胺水平被认为与冠状动脉粥样硬化斑块负荷相关,而且是人类心血管疾病的独立预测因子。氧化三甲胺会增加富含胆固醇的巨噬泡沫细胞在血管上沉积,这是动脉粥样硬化性疾病发生的最早步骤之一。肠道菌群在这方面发挥重要作用,因为富含胆碱的饮食会增加动脉粥样硬化,而使用抗生素清除肠道菌群会抑制这种反应,即使在富含胆碱的饮食中也是如此。
在小鼠血栓模型中,补充胆碱的小鼠中较高水平的氧化三甲胺与氯化铁诱导血管损伤后较短的凝血时间相关。此外,当给无菌小鼠单独补充胆碱时,对凝血时间没有影响,因此,肠道菌群在氧化三甲胺的促血栓形成表型中发挥关键作用。
富含胆碱的饮食会通过增加厚壁菌门和变形菌门细菌来诱导肠道菌群失调,将这些微生物移植到无菌小鼠肠道中,会导致血小板反应性和血栓形成增加。氧化三甲胺不直接刺激血小板,但会增强钙离子的释放和血小板激动剂的激活。
3,3-二甲基-1丁醇(DMB)是一种胆碱结构类似物,可以通过抑制肠道微生物裂解酶三甲胺来减少三甲胺的产生,从而降低氧化三甲胺的水平。通过使用DMB降低氧化三甲胺水平可以减少动脉粥样硬化病变的大小。

其它与心血管疾病风险相关的微生物代谢物有胆汁酸和短链脂肪酸。胆汁酸在肝脏中由胆固醇合成,对粪便中胆固醇的排出至关重要。肠道菌群的改变会减少胆汁酸的合成,导致胆固醇排出减少,增加心血管疾病的风险。短链脂肪酸是肠道微生物发酵不可消化的膳食纤维产生的,虽然高水平的短链脂肪酸通常被认为具有抗炎作用,但如果不受控制,可能是心血管疾病的危险因素。
2、炎症和肠道菌群失调
炎症是静脉血栓栓塞的重要危险因素。炎症会激活内皮细胞、血小板和白细胞启动凝血。它也会导致消耗性凝血病和促炎细胞因子、趋化因子和各种白细胞亚型的增加。
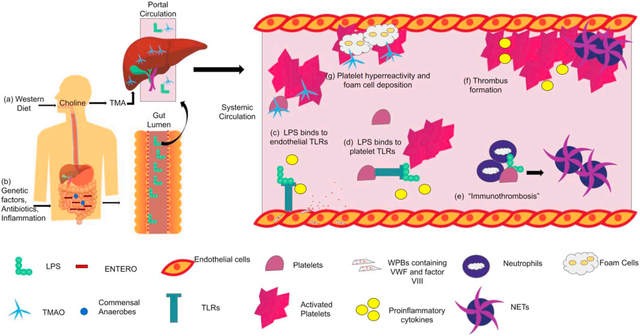
肥胖、败血症/感染、炎症性肠病和肠衰竭等炎症状态都与静脉血栓栓塞的高发病率相关。同时,它们也与肠道菌群失调有关。遗传和许多环境因素也可导致肠道菌群失调,表现为微生物多样性减少,有益微生物减少,而一些病原菌过度生长,比如肠杆菌科细菌。肠杆菌科细菌是革兰氏阴性兼性厌氧菌,在有氧或无氧的情况下都能生长,而且被认为是有害的、致病性的和促炎的细菌。肠杆菌科细菌的增加会导致肠腔内LPS的产生增加。LPS通过受损的肠道上皮屏障转运进入门静脉,然后进入体循环。
LPS是肠道菌群失调和血栓形成之间的联系之一,这是存在于革兰氏阴性细菌外膜上的一种糖脂类。LPS是一种热稳定的内毒素,可以通过局部或全身感染进入血液。
在败血症中,患者的LPS水平比健康对照组高100倍,这会导致炎症细胞因子的过度产生和革兰氏阴性感染性休克的临床表现,比如器官衰竭、低血压、呼吸窘迫以及凝血级联反应失调引起的弥散性血管内凝血。
代谢性内毒素血症是一种血浆LPS水平长期升高的疾病,会导致慢性炎症状态,但是LPS水平要比败血症低10-50倍。代谢性内毒素血症是由细菌及其内毒素(比如LPS)通过易位进入身体循环引起的。
代谢性内毒素血症已被证明存在于各种疾病状态中,比如动脉粥样硬化、自身免疫性疾病、代谢综合征、肝硬化、抑郁症、2型糖尿病、肥胖、创伤性脑损伤、多器官衰竭等等。在炎症性肠病中,患者肠道菌群中肠杆菌科细菌的丰度与血清LPS水平升高有关。肝硬化患者同样有较高水平的血清LPS,继发于细菌及其产物从肠腔转位进入门静脉和体循环。这些发现也在小鼠模型中得到了证实,因为高脂饮食会诱导小鼠肠道菌群的变化,导致革兰氏阴性菌的丰度增加和肠道通透性增加,从而导致LPS易位进入体循环,从而导致代谢性内毒素血症。
最早的测量代谢性内毒素血症中低水平的LPS的方法就是利用LPS的促凝血作用。有一种形似蟹状的海生节肢动物叫做鲎,它的血液对LPS非常敏感,在LPS的存在下会发生凝结,通过测量鲎血液中凝血级联反应的激活来确定患者血浆中是否存在LPS。
LPS水平升高导致的高凝状态,在各种疾病状态和小鼠模型中已经得到证实。在肝硬化患者中,血清LPS水平升高与凝血因子VIII水平、血管性血友病因子和凝血酶生成呈正相关。肠内不可吸收抗生素的使用可以导致LPS水平降低,并伴随凝血酶产生的减少。同样,在炎症性肠病患者中,LPS水平与D-二聚体和凝血酶原片段水平相关,并且这种相关性在结肠疾病患者中更强,因为结肠中的细菌负荷比胃肠道其它部分更高。在氯化铁诱导的小鼠血管损伤模型中,LPS会促进血栓形成,即使在没有引起血管损伤的较低氯化铁浓度下,LPS也会增强血栓形成。
3、Toll样受体通路与高凝血状态
LPS是通过Toll样受体(TLR)激活先天免疫系统的关键因子,这一受体在免疫细胞和非免疫细胞上均有表达,包括巨噬细胞、淋巴细胞、内皮细胞、树突状细胞和血小板。Toll样受体也是先天免疫系统的关键激活因子,可识别细菌、病毒和真菌中的相关分子,在先天免疫系统的激活中发挥关键作用。
目前已经发现了10多种不同的toll样受体,其中研究最多的是TLR2和TLR4,它们在有核内皮细胞、白细胞和血小板上表达。血小板TLR是“血栓性炎症”的桥梁,其作用包括炎症、血小板粘附和聚集以及中性粒细胞胞外诱捕网的形成。也有研究表明,较高水平的TLR表达可能与心血管风险和炎症生物标志物相关。
TLR4是LPS在有核细胞和血小板上的主要受体。在炎症性肠病患者的临床研究中,LPS水平与TLR4浓度呈正相关,LPS-TLR4信号通路在引发炎症性肠病患者的凝血中发挥作用。 对LPS水平升高的肝硬化患者的血小板进行的离体研究显示,与健康对照相比,低于阈值浓度的常见激动剂(比如腺嘌呤二磷酸或胶原蛋白)就可以促进血小板聚集增加,而与血小板计数无关,当TLR4被抑制时,这种反应也减弱了。
TLR4存在于含有怀布尔-帕拉德小体(webel-palade body)的内皮细胞上,怀布尔-帕拉德小体可以储存和释放血管炎症调节因子,包括血管性血友病因子、凝血因子VIII和P选择素。LPS激活内皮细胞上的TLR4,导致促炎细胞因子的释放以及怀布尔-帕拉德小体胞吐释放凝血因子VIII和血管性血友病因子,促进高凝血状态。
在血小板上,TLR4通过增加与中性粒细胞的结合、中性粒细胞胞外诱捕网的形成以及组蛋白介导的血小板反应,来调节血小板与中性粒细胞的相互作用,从而增加凝血酶的产生。

内皮细胞和血小板上也发现有TLR2。TLR2通常与TLR1或TLR6形成异源二聚体,识别革兰氏阳性菌和一些革兰氏阴性菌上的多种肽聚糖。
TLR2通路对内皮细胞至关重要,肝内皮细胞上的TLR2受体激活会导致血管性血友病因子增加,动脉血栓生长增加。无菌小鼠和TLR2缺陷小鼠的血栓形成减少,因此,肠道菌群对TLR2的激活非常重要。此外,用TLR2激动剂处理人脐静脉内皮细胞会导致促凝作用,增加组织因子、纤溶酶原激活物抑制剂-1的产生,减少组织纤溶酶原激活物和组织因子途径抑制物的产生。
同时,LPS与血小板上的TLR结合,会导致血小板活化,α-颗粒和致密颗粒的释放以及细胞因子的释放,增加血栓形成风险。
4、LPS与凝血级联反应
接触活化途径(内源性途径)内毒素血症中LPS水平升高可直接激活血管舒缓素-激肽系统。血管舒缓肽的产生可激活接触因子,从而激活内源性凝血系统并裂解高分子量的激肽原,从而释放促炎介质缓激肽。激肽原也是一个重要的LPS载体,因为缺乏激肽原的小鼠对LPS诱导的死亡有抵抗力,补充激肽原可以恢复动物的易感性。
在单核细胞中,接触因子诱导的白细胞介素IL-1的释放在LPS的存在下会大大增加。此外,接触因子处理的脾树突状细胞暴露于LPS,会产生更高数量的IL-6和IL-23。
组织因子途径(外源性途径)LPS也能影响外源性凝血级联反应。在凝血级联反应中,磷脂酰丝氨酸通过增加组织因子与凝血因子VII的结合以及辅因子-蛋白酶复合物的形成来增强组织因子的活性。磷脂酰丝氨酸通常存在于质膜的内小叶中,在LPS的存在下,会翻转到质膜的外小叶,导致组织因子激活。
外源性途径与内毒素血症之间也存在重要联系,因为抑制组织因子可以防止内毒素血症诱导的弥散性血管内凝血。血小板高反应性、凝血因子的释放、细胞因子的释放和中性粒细胞胞外诱捕网的形成共同作用,可导致高凝状态,并可能导致血栓形成。
5、免疫性血栓形成
免疫性血栓形成是通过招募先天免疫细胞和血小板,在血管中形成血栓,引起先天免疫反应,识别、遏制和破坏病原体,阻止病原体的传播。中性粒细胞、单核细胞和树突状细胞共同作用,通过纤维蛋白形成和血小板活化启动,抑制病原体在脉管系统中的传播。“免疫血栓”不同于原发性和继发性止血过程,因为它主要发生在血管内腔,可能是预防病理性血栓形成的一种新的治疗选择。止血和免疫血栓形成都是阻止失血和血管内病原体的传播,但异常激活可导致常见于心血管疾病和深静脉血栓中的病理性血栓形成。
中性粒细胞中性粒细胞是先天免疫的主要效应因子,在宿主防御和血栓形成中具有双重功能。它们与血小板在血管损伤部位迅速聚集,可促进心血管疾病大血管血栓形成。激活后,中性粒细胞会释放中性粒细胞胞外诱捕网, 这是由DNA纤维、组蛋白和抗菌蛋白组成的网状结构,负责捕获和杀死细胞外病原体,在抗菌防御中发挥保护作用。然而,它们也可以诱导强烈的促凝反应,并通过导致炎症性疾病和输血相关性急性肺损伤等病理后果对组织造成伤害。
免疫血栓中,中性粒细胞胞外诱捕网的形成会导致血小板与中性粒细胞相互作用,激活接触因子并促进聚集。中性粒细胞胞外诱捕网的胞外核小体的组蛋白组分可以激活TLR2和TLR4。激活的中性粒细胞会沉积丝氨酸蛋白酶,使一些重要的抗凝剂失活,比如组织因子途径抑制剂和血栓调节蛋白,从而导致高凝血状态。
中性粒细胞胞外诱捕网还可以通过激活接触因子,并结合血管性血友病因子,促进血小板募集和活化。TLR4通路还通过增加内皮细胞内重要粘附分子的表达,包括细胞间粘附分子-1,诱导中性粒细胞胞外诱捕网的形成。
此外,在临床前模型中,用分解中性粒细胞胞外诱捕网的脱氧核糖核酸酶处理小鼠,阻断中性粒细胞胞外诱捕网的形成,可以防止血栓形成。
血小板血小板通过病原体识别和先天免疫细胞参与的促血栓形成通路的增强,在免疫血栓形成中发挥关键的支持作用。血小板会与血液中的细菌上的LPS结合,并将这些病原体呈递给中性粒细胞和其它先天免疫细胞。
在动脉血栓中,它们是第一批被招募到内皮破坏部位的细胞,并导致粘附分子的表达和趋化因子的释放,以招募先天免疫细胞。
在深静脉血栓中,血小板在炎症部位聚集,参与与中性粒细胞和单核细胞的受体依赖性结合,并指导血小板与内皮细胞的相互作用,促进额外的免疫细胞募集。
总结
肠道菌群在人类健康各个方面的作用越来越被人们所认识。血栓形成是凝血系统、先天免疫系统和炎症之间复杂的相互作用,肠道菌群在血栓栓塞的发生中也发挥着重要作用。
一些会增加血栓栓塞风险的疾病状态与肠道菌群失衡有关,其特征是有益菌减少和致病菌丰度增加,其中最常见的是革兰氏阴性的肠杆菌科的细菌。肠杆菌科细菌的增加会导致肠腔内LPS的产生增加。LPS通过受损的肠道上皮屏障转运进入门静脉,然后进入体循环。
细菌LPS正是肠道菌群失调与血栓形成之间的联系之一。LPS激活内皮细胞上的TLR4,导致促炎细胞因子的释放以及怀布尔-帕拉德小体胞吐释放凝血因子VIII和血管性血友病因子。LPS与血小板上的TLR结合,导致血小板活化,α-颗粒和致密颗粒的释放以及细胞因子的释放。TLR还通过与中性粒细胞结合,增加中性粒细胞胞外诱捕网的形成,调节血小板-中性粒细胞的相互作用和免疫血栓形成,从而激活凝血级联反应。
肠道细菌也可以代谢饮食中的某些化合物,产生一些重要的代谢物。比如食物中的胆碱可以被肠道细菌的三甲胺裂解酶代谢为三甲胺,然后通过门静脉循环进入肝脏,在那里转化为氧化三甲胺,并释放到血液循环中。氧化三甲胺一旦进入体循环,会导致血小板高反应性,促进血栓形成,并与心血管疾病有关。
血栓栓塞事件是一个快速增长的临床问题,症状因血栓的位置而异,严重者可危机生命,随着时间的推移,它会变得更加危险。越早发现,越早寻求治疗,就越有可能得到好的结果。预防也尤为重要,任何干扰血液自由流动或正常凝血的因素都会增加患血栓的风险,包括许多疾病、药物和生活方式因素。
肠道菌群在血栓形成中的作用对于优化治疗和开发新的预防和治疗策略至关重要。调节肠道菌群,特别是靶向LPS和氧化三甲胺水平,可能是降低血栓形成风险的一种创新方法。
图片均来自网络
参考资料:
Hasan RA, Koh AY, Zia A. The gut microbiome and thromboembolism. Thromb Res. 2020 May;189:77-87. doi: 10.1016/j.thromres.2020.03.003. Epub 2020 Mar 6. PMID: 32192995; PMCID: PMC8780211.
