研究背景
原发性中枢神经系统肿瘤是儿童最常见的恶性肿瘤,也是0-19岁儿童癌症相关发病和死亡的最常见原因。高级别胶质瘤、弥漫内生性桥脑胶质瘤预后较差,髓母细胞瘤和室管膜瘤等复发后预后较差。免疫治疗在多种实体肿瘤中疗效显著。免疫检查点抑制剂(ICIs)是目前最常用的免疫治疗手段,其中纳武单抗(Nivolumab,NIVO)和伊匹单抗(Ipilimumab,IPI)是完全人源化IgG单克隆抗体,分别针对PD-1和CTLA-4,已获批治疗多种晚期癌症。
针对脑瘤的ICIs研究主要针对成人GBM患者,但尚无获批的适应证。正在进行的临床研究包括CheckMate 143、CheckMate548以及近期结束的CheckMate 498。CheckMate 143的1期探索性研究发现NIVO±IPI对成人复发GBM耐受性良好,存在一定的抗肿瘤活性,但OS与历史对照组一致。CheckMate548及CheckMate 498应用NIVO治疗成人新诊断GBM,未达到主要的研究终点。对于儿童患者,NIVO和IPI在复发/难治性非中枢神经系统实体瘤和淋巴瘤中均有较好的耐受性。本研究(CheckMate 908,NCT03130959)是一项开放标签,序贯Ib/2期临床研究,应用NIVO单药及NIVO+IPI治疗儿童新诊断DIPG以及多种复发/进展性中枢神经系统恶性肿瘤。主要研究了上述药物的疗效、安全性、生物标志物以及药代动力学。
研究方法
(1)患者
本研究共有5个队列:队列1:经组织学或MRI确诊的新诊断的DIPG(包括存在H3K27M突变的弥漫中线胶质瘤),距放疗结束4周之内。队列2:经组织学证实的复发/进展非脑干高级别胶质瘤,既往接受手术及放疗,无论是否接受化疗;队列3:经组织学证实的髓母细胞瘤,对包括手术、放疗或化疗在内的≥1种疗法复发或耐药;队列4:经组织学证实的室管膜瘤,对包括手术、放疗或化疗在内的≥1种疗法复发或耐药;队列5:除队列1-4外,各种复杂和罕见的组织学证实的高级别中枢神经系统恶性肿瘤,在≥1线治疗后复发或进展。
入组标准:所有患者既往均接受了标准的治疗手段,或没有可用的治愈性治疗手段。入组年龄≥0.5岁且<22岁,入组2周内的Lansky评分(年龄≤16岁)或Karnofsky表现评分(年龄>16岁)≥60。队列2-5的患者入组时距放疗的间隔需≥12周(除病理学证实肿瘤复发或在原放射野外出现新的强化病灶)。入组时距上一次抗肿瘤治疗需≥4周(短半衰期的靶向药物需在5个半衰期以上,贝伐珠单抗需5周以上,亚硝脲类药物需6周以上,其他生物制剂的间隔时间为7天或5个半衰期,以较长者为准)。患者在入组前尽量停止皮质醇使用,或逐渐减少,可接受地塞米松≤0.05mg/kg/d(或等效剂量其他激素)。基线皮质醇的使用应从首次用药前5日开始,但不作为排除标准。若患者既往接受自体干细胞支持的大剂量化疗,则必须距自体造血干细胞移植≥6月,CD4≥200/mm3。
排除标准:既往接受过异体骨髓移植,接受过抗PD-1、PD-L1、PD-L2、CTLA-4药物,或其他针对T细胞共刺激或检查点通路的抗体;接受任何研究性治疗或研究性放疗;低级别胶质瘤;恶性程度不明的肿瘤;肿瘤体积>6cm;近期1级以上中枢神经系统出血(基线MRI显示);已知或疑似的自身免疫性疾病。
(2)研究设计和治疗
患者被纳入2个组别,A组接受NIVO 3mg/kg静脉注射,每2周1次(NIVO3)。B组接受NIVO 3mg/kg+IPI 1mg/kg,静脉注射,每3周1次(共4次),后续接受NIVO 3mg/kg,每2周1次(NIVO3+IPI1)。本研究分为安全性导入阶段和扩展阶段,安全性导入期患者在用药3次和≥6周后接受安全性和耐受性评估。并纳入扩展阶段疗效评估。A组对所有组别进行平行招募,B组在A组招募完成后由研究者决定按队列开放。
本研究的主要终点是安全性导入阶段的安全性和耐受性,队列1为OS,扩展阶段队列2-5的PFS。次要研究终点包括扩展阶段的安全性和耐受性,队列1的PFS和12m-OS,队列2-4的OS,6m-PFS和12m-OS,队列5的OS和6m-PFS。探索性终点包括药代动力学和生物标志物。
(3)疗效评价
根据RANO标准,最佳OS通过MRI增强像进行评价,入组后每6周1次(共2次)后续每8周1次(共4次),后续每12周1次直至疾病进展。队列1的OS定义为自确诊至死亡或最后已知生存日期,其他队列自开始用药至死亡或最后已知生存日期。队列1的OS考虑到与历史研究进行比较。在治疗结束后约100日进行随访,后续每3月1次。在队列1中,若RT后12周之内出现疑似进展,则需考虑假性进展。若大部分新增强化在放射野之外,或存在病理证据则确定为PD。假性进展定义为临床症状无恶化,并且在报告PD后≥3个月的第一次随访时肿瘤进展(包括因肿瘤死亡)。最开始符合疾病进展的影像学标准,但能耐受治疗的患者可继续治疗直至确定疾病进展。PD-L1的表达通过免疫组化进行,定义为≥100个可评估的肿瘤细胞中膜染色阳性细胞的百分比。PD-L1阳性的阈值是1%和5%。同时进行肿瘤突变负荷(TMB)和遗传学检测(如H3K27M突变、BRAF突变、RELA融合等)。
研究结果
(1)患者特征
共有204名患者纳入研究,来自15个国家的166名患者在51家机构接受治疗(NIVO3组85名,NIVO3+IPI1组81名)。两组间患者的基线特征是相似的,且对该疾病具有代表性。NIVO3组和NIVO3+IPI1组的中位年龄分别为10岁和11岁。在基线PD-L1阳性的患者中,PD-L1表达≥1%的患者分别为33.9%(NIVO3)和26.3%(NIVO3+IPI1)。基线时应用皮质醇的患者分别为20%(NIVO3)和12.3%(NIVO3+IPI1)。
在数据截止时,NIVO3组化疗中位数为5次,NIVO3+IPI1组治疗中位数为4次。绝大多数患者提前停止治疗(NIVO3组:96.5%,NIVO3+IPI1组,97.5%)。主要原因是肿瘤进展(NIVO3组,74.1%;NIVO3+IPI1组,64.2%)和治疗相关毒性(NIVO3,11.8%;NIVO3+IPI1,13.6%)。NIVO3组的随访时间中位数为8.1(0.2-41.7)月,NIVO3+IPI1组为10.8(0.7-34.7)月。
(2)疗效
队列1(DIPG,n=40):NIVO3组(n=23)的中位OS为11.7月,NIVO3+IPI1组(n=22)为10.8月;NIVO3组的12个月OS率为48.0%,NIVO3+IPI1组为42.9%。NIVO3组的中位PFS为6.2月,NIVO3+IPI1组为4.5月。
队列2(HGG,n=31):NIVO3组(n=16)的中位OS为6.7月,NIVO3+IPI1组(n=15)为8.5月;NIVO3组的12个月OS率为37.5%,NIVO3+IPI1组为35.4%。NIVO3组的中位PFS为1.7月,NIVO3+IPI1组为1.3月;两组6个月PFS率分别为9.4%和15.4%。
队列3(复发/耐药MB,n=30):NIVO3组(n=15)的中位OS为7.4月,NIVO3+IPI1组(n=15)的中位OS为22.2月;NIVO3组的12个月OS率为38.9%,NIVO3+IPI1组为86.7%。NIVO3组的中位PFS为1.4月,NIVO3+IPI1组为2.8月;两组6个月PFS率分别为0%和20.0%。
队列4(复发/耐药室管膜瘤,n=22):NIVO3组(n=12)的中位OS为5.7月,NIVO3+IPI1组(n=10)为9.8月;NIVO3组的12个月OS率为41.7%,NIVO3+IPI1组为44.4%。NIVO3组的中位PFS为1.4月,NIVO3+IPI1组为4.6月;两组6个月PFS率分别为27.3%和11.4%。
队列5(复发/进展的其他高级别肿瘤,n=38):NIVO3组(n=19)的中位OS为5.9月,NIVO3+IPI1组(n=19)为8.5月。NIVO3组的中位PFS为1.2月,NIVO3+IPI1组为1.6月;两组6个月PFS率分别为5.3%和14.0%。
在NIVO3组中有2名患者出现假性进展(分别为队列2、队列3)。所有患者中,经研究者评估的PD率为88.6%,75.3%的患者在治疗后6个月以内出现PD。从PD到死亡的中位时间为4.04月。各组从PD到死亡的中位时间分别为:队列1为3.59月,队列2为2.96月,队列3为7.95月,队列4为3.11月,队列5为3.96月(图2、3)。
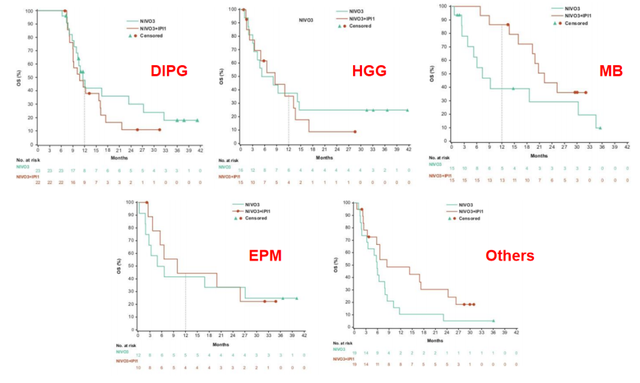
图2:不同队列患者的PFS(绿色:NIVO3;褐色:NIVO3+IPI1)

图3:不同队列患者的OS(绿色:NIVO3;褐色:NIVO3+IPI1)
(3)安全性
有57.6%(NIVO3组)和64.2%(NIVO3+IPI1组)的患者发生治疗相关的不良事件(TRAEs);其中14.1%(NIVO3组)和27.2%(NIVO3+IPI1组)的患者发生3/4级TRAEs。NIVO3组和NIVO3+IPI1组最常见的(任一组别出现比例>10%)任何等级的TRAE是疲劳(10.6%和8.6%)、ALT升高(8.2%和11.1%)和AST升高(7.1%和12.3%)。16.5%的NIVO3组患者和13.6%的NIVO3+IPI1组患者出现任何等级的神经系统TRAE。最常见的是头痛(NIVO3组7.1%;NIVO3+IPI1组6.2%)。38.8%(NIVO3)和61.7%(NIVO3+IPI1)的患者发生严重(3/4级)AE。最常见的严重AE包括NIVO3组的中性粒细胞计数减少(5.9%)和恶性肿瘤进展(4.7%);NIVO3+IPI1组的呕吐(8.6%)和头痛(8.6%)。没有观察到5级TRAEs(表2)。

表2:治疗相关的不良事件
共有10名NIVO3组患者(11.8%)和14名NIVO3+IPI1组患者(17.3%)出现导致停药的TRAEs。导致1名以上患者停药的TRAE包括NIVO3组的肝炎和皮疹,NIVO3+IPI1组的结肠炎、ALT升高和AST升高。队列5中的1名患者出现了剂量限制性毒性,非典型脑膜瘤,应用NIVO3+IPI1,出现了3级胰腺炎和2级结肠炎。在NIVO3和NIVO3+IPI1组中,分别有66和59名患者死亡;其中34和19名患者在最后一次服用研究药物后≤100天死亡。死亡的主要原因是肿瘤进展(NIVO3组64/85(75.3%);NIVO3+IPI1组58/81(71.6%))。三名患者在PD后死亡,死因与研究药物无关。
(4)标志物
在接受NIVO3治疗的85名患者中,有62名可以评估基线PD-L1染色情况,在NIVO3+IPI1组的81名患者中有57名可评估。队列1大部分患者未接受手术,因此无法评估。两组患者肿瘤PD-L1的表达与预后无关。共有38名患者可评估TMB(NIVO3,组15名;NIVO3+IPI1组23名),其中1名复发/进展HGG患者TMB较高(外显子组中有7802个体细胞突变),该患者PD-L1表达为5%,但对治疗无反应(NIVO3+IPI1)。其余患者体细胞突变数量均<100。1名接受NIVO3治疗的复发/耐药室管膜瘤患者达到PR,该肿瘤为微卫星高度不稳定型(MSI-H),OS为13.6月。1名接受NIVO3治疗的复发/进展HGG患者PD-L1表达达到40%,OS达到41.7月。本研究中所有类型肿瘤的CD8+肿瘤浸润淋巴细胞均为低水平或不存在,这显示肿瘤为免疫学的“冷肿瘤”,这与既往对DIPG和儿童低级别/高级别胶质瘤中的结果相同。
(5)后续治疗
在NIVO组中,共有38名患者(44.7%)接受了后续治疗,而NIVO3+IPI1组为34名患者(42%)。后续治疗包括新的抗肿瘤药物治疗、治疗性的放疗或手术治疗。其中最常见的治疗手段为药物治疗。
讨论和结论
CheckMate 908研究未达到研究重点,对于即未能观察到NIVO±IPI治疗儿童DIPG或高级别复发/进展性CNS恶性肿瘤患者OS和PFS的获益。本研究并未在不同队列或治疗方法间进行比较,而是与历史研究进行比较。既往研究显示,新诊断DIPG的中位OS为9.6月,复发/进展性儿童HGG的中位PFS为2.25月,复发/耐药室管膜瘤的中位PFS为2.1月,复发/耐药MB的4个月PFS为18%。在本研究中,新诊断DIPG的中位OS为11.7月(NIVO3)/10.8月(NIVO3+IPI1),复发/进展性儿童HGG的中位PFS为1.7月(NIVO3)/1.3月(NIVO3+IPI1),复发/耐药室管膜瘤的中位PFS为1.4月(NIVO3)/4.6月(NIVO3+IPI1)。复发/耐药MB的4个月PFS为0%(NIVO3)/40%(NIVO3+IPI1),NIVO3+IPI1组观察到生存改善的趋势,但无统计学差异。对于其他高级别CNS肿瘤,由于历史数据缺乏,难以进行比较。本研究的数据与既往儿童复发/难治性非CNS实体肿瘤的生存数据相比,NIVO单药无明显的优势。
虽然对PD-1治疗的敏感性可能取决于PD-L1的高表达,正如幕上RELA融合阳性室管膜瘤的研究所示。但本研究显示基线PD-L1表达≥1%或5%与PFS或OS的改善无关,虽然本研究的样本量较小无法得出确定性的结论。ICI在儿童患者中的疗效较差主要是由不常检测到PD-L1的表达。KEYNOTE-051研究利用帕博利珠单抗治疗PD-L1阳性的儿童复发/难治性淋巴瘤或实体瘤患者,大多数类型的肿瘤疗效不明显。因此,PD-L1可能不足以作为大多数儿童脑肿瘤的独立的疗效预测标志物。未来,利用放疗、化疗或其他将免疫“冷肿瘤”转变为“热肿瘤”的方式可用于提高免疫治疗的效果,另外应该探索新的对免疫疗法敏感的疗效预测标志物。
本研究中,有1名存在MSI-H型的复发/耐药室管膜瘤患者达到PR,另外1名存在高TMB的HGG的患者OS达到11月。既往针对PD-1抑制剂的研究显示,TMB是重要的疗效预测因子,包括存在错配修复缺陷的复发GBM。另外,本研究中有4名患者存在肿瘤易感综合征。包括1名存在复发/进展性HGG的患者患有错配修复缺陷综合征,该患者既往曾患有T细胞急性淋巴细胞白血病(PFS 40.8月,OS 41.7月)。1名存在存在复发/进展性HGG的患者患有Lynch综合征(PFS 1.3月,OS 8.5月)。2名复发/进展性脉络丛癌患者患有Li-Fraumeni综合征(PFS 34.5月,OS 36.2月和PFS 1.2月,OS 8.0月)。
本研究中,NIVO±IPI治疗的耐受性良好,未出现新的或预料之外的安全性事件。NIVO3+IPI1的TRAEs、严重TRAEs和导致停药的TRAEs发生率更高,这是符合预期的。1名接受NIVO3+IPI1治疗的患者出现剂量限制性毒性。
CheckMate 908研究并未显示出具有临床意义的疗效,不支持NIVO±IPI在儿童CNS恶性肿瘤中的进一步研究。但这并不意味着免疫治疗在儿童CNS肿瘤中的悲观前景。相反,儿童CNS恶性肿瘤对PD-1和CLTA-4靶向治疗的低有效率,以及低TMB和免疫学上的“冷肿瘤”特征对研究新的免疫治疗机制和开发新的免疫疗法提供了很好的启示。
参考资料:Ira J. Dunkel et al. Nivolumab With or Without Ipilimumab in Pediatric Patients With High-Grade CNS Malignancies: Safety, Efficacy, Biomarker, and Pharmacokinetics: CheckMate 908. Neuro Oncol. 2023
敬请注意:本文仅供相关专业人员学习参考之用,文中的所有信息均不作为诊断和治疗疾病的依据。如出现文中描述的症状,请及时就医。另外,本文仅节选原文的一部分,内容可能不完整或与原文存在偏差,若需更完整的信息请参阅原文。
撰稿:赵赤
审校:张俊平
排版:郜志孟
