*仅供医学专业人士阅读参考


抗生素的研发,终于迈入了新时代。
今天,由伊利诺伊大学厄巴纳-香槟分校Paul J. Hergenrother领衔的研究团队,在顶级期刊《自然》上发表一项重磅研究成果[1]。
他们在前人的工作基础上,开发了一种全新的抗生素——lolamicin。与传统抗生素相比,lolamicin专杀革兰氏阴性病原菌,对革兰氏阴性共生菌和革兰氏阳性菌没有杀伤活性;更神奇的是,lolamicin竟然不会导致肠道菌群紊乱,要知道这可是所有抗生素的通病。
基于以上各种特征,《自然》杂志同期配发的评论文章称lolamicin为“智能”抗生素[2]。Hergenrother也认为,他们开启了下一代抗生素研发理念:特异性杀死一类病原菌而不损害有益健康的肠道菌群[3]。

论文首页截图
抗生素为人类的健康立下了汗马功劳。
近年来,随着科学家对人体共生微生物的深入研究,肠道菌群微生态对人体健康的重要性越来越被重视。因此,抗生素破坏肠道菌群健康状态的一面也逐渐被重视。
目前,临床使用的主要抗生素可以简单地分成两大类:可以杀死革兰氏阴性菌和革兰氏阳性菌的广谱抗生素,以及仅杀死革兰氏阳性菌的抗生素。不过,无论是上述哪一大类抗生素,它们都对肠道共生菌有害,会引起肠道菌群失调。
至于专杀革兰氏阴性菌的抗生素,目前投入临床使用的极少。即使是罕见的几个革兰氏阴性菌抗生素,它们对肠道共生菌也有杀伤活性,毕竟革兰氏阴性细菌在所有肠道微生物中占比在47%左右。此外,Hergenrother团队还注意到,美国FDA已经有50多年没有批准过针对革兰氏阴性菌的抗生素了。

Paul J. Hergenrother(左二大高个)和他的团队成员(图源:伊利诺伊大学厄巴纳-香槟分校)
在上述背景之下,Hergenrother和他的同事们想开发一款只杀革兰氏阴性致病菌,不伤有益菌的抗生素。
他们把切入点定在负责革兰氏阴性菌内外膜之间脂蛋白转运的Lol系统上。Lol系统是革兰氏阴性菌专有的,而且在革兰氏阴性多重耐药超级致病菌(肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌和肠杆菌属细菌)中是保守的。
有意思的是,这些“毒王”的Lol系统与在人体内共生的革兰氏阴性菌同源性很低。这就给了Hergenrother团队一个开发双重选择性抗生素的机会。好消息是,他们不用重头开始,因为早在2015年就有科学家筛选到了两个靶向Lol系统的抑制剂(化合物1和化合物2)[4]。遗憾的是,那两个抑制剂因为多种原因无法成药。
Hergenrother和他的同事在观察2015年筛选到的两个药物的结构之后,发现这俩药物有个共同的支架结构,于是他们围绕这个支架开始了不断地迭代调整,最终得到了lolamicin。
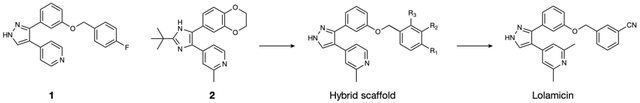
lolamicin诞生过程
初步研究结果显示,lolamicin对实验室里的多种革兰氏阴性致病菌都有明显的活性,而且对一系列革兰氏阳性需氧病原菌,以及一系列革兰氏阳性和革兰氏阴性厌氧共生菌没有活性;对哺乳动物细胞系和红细胞的毒性也非常小。
在对具备多重耐药特性的大肠杆菌开展的药敏研究中,他们发现浓度为1-2μg/ml的lolamicin能杀死50%的细菌,4μg/ml时能杀死90%的细菌,8μg/ml时能杀死所有细菌,效果远远优于化合物1。

lolamicin对不同菌株的杀伤活性
从作用机制上看,电镜成像结果显示,lolamicin是通过直接占据脂蛋白结合位点,竞争性地抑制了脂蛋白的转运。
紧接着,Hergenrother团队测试了lolamicin在体内的效果。基于几种耐药革兰氏阴性致病菌的研究表明,lolamicin的口服生物利用度很高,在体内有良好的抗菌活性,可大幅提升感染小鼠的存活率。

lolamicin的体内活性
在研究的最后,Hergenrother团队探索了口服lolamicin对肠道微生物生态的影响。
通过与空白对照、阿莫西林(广谱抗生素)和克林霉素(针对革兰氏阳性菌)的比较,他们发现lolamicin处理不会导致任何菌株的占比发生重大变化,也不会影响肠道菌群的多样性。
此外,他们还探索了抗生素治疗之后的艰难梭菌继发性感染问题。结果显示,阿莫西林和克林霉素治疗后,都会出现艰难梭菌大爆发,而lolamicin治疗之后则不会。要知道,艰难梭菌继发性感染也是目前临床上正在使用抗生素的通病。

lolamicin不会给肠道菌群造成巨大扰动
总的来说,Hergenrother团队成功筛选到了一种具备双重选择性的抗生素:专杀革兰氏阳性病原菌,而不伤害肠道共生菌生态。这一发现也为新一代抗生素的研发指明了方向。
需要指出的是,目前关于这个抗生素的研究仍处于小鼠阶段,在小鼠身上的成功是否能在人身上复制,还需要科学家进一步去验证。
不过,无论如何,Hergenrother团队证实的这个抗生素开发概念,应该是未来抗生素研发的大方向,毕竟肠道菌群影响人类健康的观念已经深入人心。
参考文献:
[1].Muñoz, K.A., Ulrich, R.J., Vasan, A.K. et al. A Gram-negative-selective antibiotic that spares the gut microbiome. Nature (2024). doi:10.1038/s41586-024-07502-0
[2].https://www.nature.com/articles/d41586-024-01566-8
[3].https://news.illinois.edu/view/6367/668002791
[4].Nayar AS, Dougherty TJ, Ferguson KE, et al. Novel antibacterial targets and compounds revealed by a high-throughput cell wall reporter assay. J Bacteriol. 2015;197(10):1726-1734. doi:10.1128/JB.02552-14


本文作者丨BioTalker
