转自:药明康德
ProtaraTherapeutics公司日前公布了正在进行中的开放标签2期临床试验ADVANCED-2的最新结果。该试验评估了其在研细胞疗法TARA-002对携带高风险原位癌的非肌层浸润性膀胱癌(NMIBC)患者的疗效,包括对卡介苗(BCG)无应答或为BCG初治患者。

主要研究结果显示:
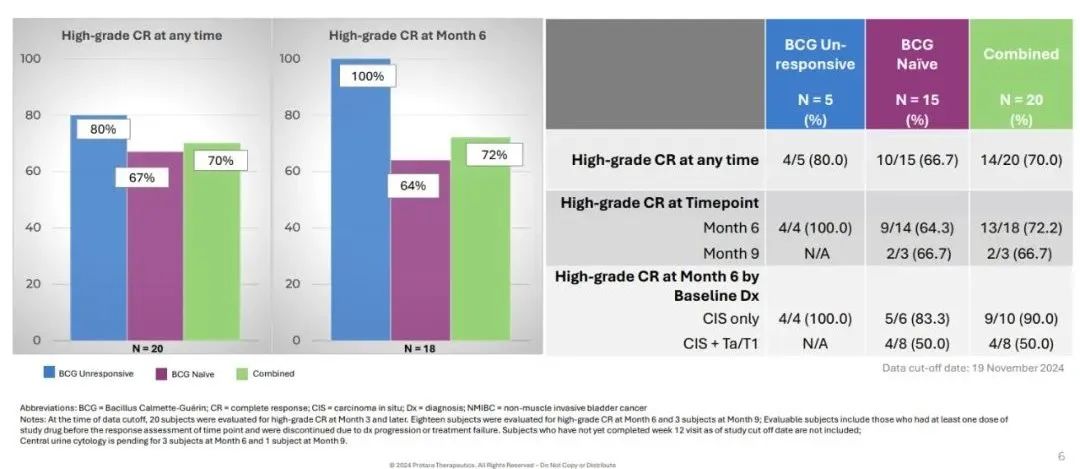
在所有患者中,接受治疗后6个月时的完全缓解(CR)率为72%(13/18),任意时间点的CR率为70%(14/20)。
在接受治疗后3个月时获得完全缓解的9名患者中,所有患者在6个月时均维持完全缓解。
在3位随访时间达到9个月的可评估患者中,有2位在9个月时仍保持完全缓解。
值得一提的是,在对BCG无应答的患者队列中,接受治疗6个月时的CR率为100%(4/4),任意时间点的CR率为80%(4/5)。
TARA-002展现出良好的安全性和耐受性,没有观察到2级或更高的治疗相关不良事件(TRAEs)。大多数不良事件为1级,且为短暂性,没有患者因不良事件而停止治疗。最常见的不良事件包括与细菌免疫增强反应相关的流感样症状,以及尿路操作引起的膀胱痉挛、灼热感和尿路感染等尿路症状,且大多在给药后数小时至几天内缓解。
TARA-002是一款在研细胞疗法,基于一种失活的化脓性链球菌(Streptococcuspyogenes)菌株。该菌株与已在日本获批上市的Picibanil源于同一主细胞库。Picibanil已经在日本获批用于治疗某些癌症和淋巴管瘤。TARA-002给药后,预计会激活囊肿或肿瘤内的先天性和适应性免疫细胞,产生促炎性反应,释放多种细胞因子(如TNF-α、IFN-γ、IL-1b、IL-6、IL-12、GM-CSF)。此外,TARA-002可直接杀死肿瘤细胞,并通过诱导免疫原性细胞死亡(ICD)触发宿主免疫反应,从而进一步增强抗肿瘤免疫反应。

膀胱癌是常见癌症之一,其中约80%为非肌层浸润性膀胱癌。仅在美国,每年约有六万五千例NMIBC新确诊病例,NMIBC是指局限于膀胱内壁表层组织、未扩散至膀胱肌肉的癌症类型。BCG是治疗这些患者的标准疗法。近年来,多家公司在开发BCG之外的NMIBC疗法方面获得显著进展。今年4月,美国FDA批准ImmunityBio旗下AltorBioScience所开发的白细胞介素-15(IL-15)超级激动剂Anktiva(nogapendekinalfainbakicept)与BCG联合使用,用于治疗对BCG无应答且伴有原位癌(CIS)的NMIBC成年患者。在2/3期临床试验中,患者达到62%的CR率。
此外,CGOncology公司的在研溶瘤病毒疗法cretostimogene,在治疗对卡介苗无应答的高风险NMIBC患者的3期临床试验中获得积极结果。74.5%(82/110)的患者达到完全缓解。而且,中位缓解持续时间超过27个月。这款疗法已经被美国FDA授予突破性疗法认定和快速通道资格。
enGene公司的主打非病毒基因疗法detalimogenevoraplasmid(也称为detalimogene)在高风险、对BCG无应答、伴有原位癌的NMIBC患者中进行的LEGEND关键性试验中也获得积极结果。日前发布的数据显示,高达71%的患者达成完全缓解。
强生公司的在研膀胱内靶向释放疗法TAR-210在治疗携带特定FGFR基因变异的NMIBC患者的1期临床试验中也获得积极结果。在C3队列中,完全缓解率达到90%。
参考资料:
[1]ProtaraAnnouncesPositiveResultsfromtheOngoingPhase2ADVANCED-2TrialofTARA-002inPatientswithNMIBC.RetrievedDecember5,2024,fromhttps://www.globenewswire.com/news-release/2024/12/05/2992222/0/en/Protara-Announces-Positive-Results-from-the-Ongoing-Phase-2-ADVANCED-2-Trial-of-TARA-002-in-Patients-with-NMIBC.html
[2]ADVANCED-2TRIALINTERIMRESULTS.RetrievedDecember5,2024,fromhttps://ir.protaratx.com/static-files/e1220a6b-ce19-4fce-9b14-27407f102068