转自:医药观澜
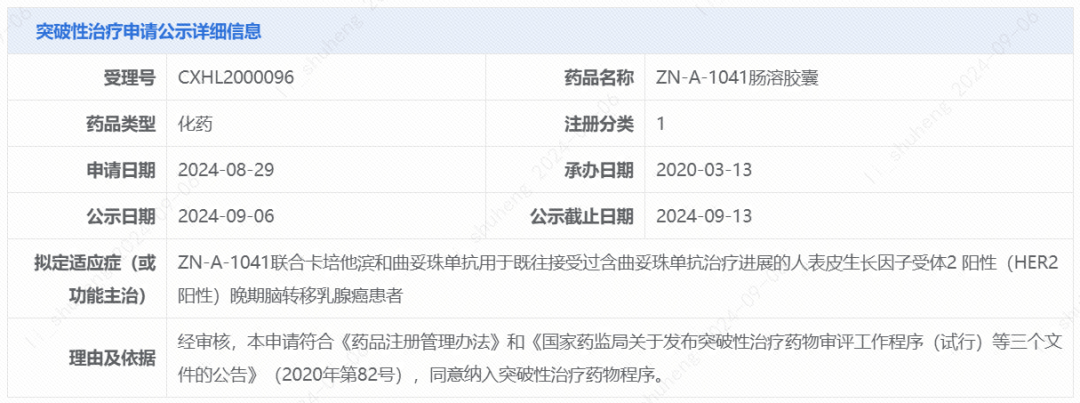
今日(9月6日),中国国家药监局药品审评中心(CDE)官网刚刚公示,苏州赞荣医药科技有限公司申报的ZN-A-1041肠溶胶囊拟纳入突破性治疗品种,适应症为:ZN-A-1041联合卡培他滨和曲妥珠单抗用于既往接受过含曲妥珠单抗治疗进展的HER2阳性晚期脑转移乳腺癌患者。
公开资料显示,ZN-A-1041是一款口服小分子HER2靶向小分子抑制剂,具备高度血脑屏障通透性。2023年5月罗氏(Roche)与赞荣医药就收购这款在研药物全球权益达成了总额约6.8亿美元的协议。
研究显示,高达50%的HER2阳性转移性乳腺癌患者在病程中会发生脑转移。脑转移与生活质量和总生存率下降有关。目前控制脑转移的主要手段是局部治疗,包括手术和放疗,但6-12个月后复发仍很常见,且会带来认知功能下降等不良结局,给临床治疗带来巨大挑战。
近年来,小分子酪氨酸激酶抑制剂(TKIs)在治疗脑转移中的潜力获得关注。ZN-A-1041正是一款靶向人表皮生长因子受体2(HER2)的口服选择性酪氨酸激酶抑制剂,同时具备高度血脑屏障通透性,可潜在用于治疗HER2阳性乳腺癌脑转移的患者以及预防脑转移的发生。

2023年美国临床肿瘤学会(ASCO)年会披露了ZN-1041的临床前和早期临床数据。ZN-A-1041-101是一项正在进行的1期、多中心、开放标签研究,评估了HER2+脑转移乳腺癌(BCBM)患者中,ZN-1041单药治疗的首次人体剂量递增评估,以及ZN-1041联合卡培他滨和曲妥珠单抗的剂量递增和扩展期评估,主要目标是安全性和耐受性。次要目标包括药代动力学和抗肿瘤反应,包括RECIST1.1标准的客观缓解率(ORR)和RANO-BM标准的颅内ORR(iORR)。
研究结果显示,在19例至少两次肿瘤评估的脑转移乳腺癌(BCBM)患者中,ZN-1041联合卡培他滨和曲妥珠单抗的总ORR为78.9%,iORR为73.7%,疾病控制率(DCR)为100%。此外,根据RECISIT1.1标准,6名患者完成了首次肿瘤评估,5名患者达到PR,1名患者达到SD。
研究人员认为,在TKI初治、HER2+BCBM患者中,ZN-1041单药或联合卡培他滨和曲妥珠单抗观察到令人鼓舞的疗效和耐受性。ZN-1041、卡培他滨和曲妥珠单抗联合治疗HER2+BCBM的2期关键试验正在计划中。
根据中国药物临床试验登记与公示信息平台,ZN-A-1041针对HER2阳性晚期实体瘤的两项研究正在进行中。其中一项1期研究,旨在评价ZN-A-1041肠溶胶囊单药或联合给药在HER2阳性晚期实体瘤患者中的安全性、耐受性、药代动力学与有效性。

参考资料:
[1]中国国家药监局药品审评中心官网.RetrievedSep6,2024,fromhttps://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]赞荣医药宣布与罗氏就穿脑化合物ZN-A-1041达成全球独家授权合作.RetrievedMay9,2023,fromhttps://mp.weixin.qq.com/s/RdK8Lj7HZseNnmqhWU2W7Q
[3]PreclinicalandearlyclinicaldataofZN-1041,abest-in-classBBBpenetrableHER2inhibitortotreatbreastcancerwithCNSmetastases..RetrievedMay31,2023,Fromhttps://ascopubs.org/doi/10.1200/JCO.2023.41.16_suppl.1040
(转自:医药观澜)