本文来源:选自《中华儿科杂志》, 2024,62(1) : 12-21.
牛奶蛋白过敏(CMPA)是一个重要的公共卫生问题,给患儿和家庭带来了重大的经济、营养和生活质量负担,影响儿童的早期健康,其临床表现缺乏特异症状及体征,严重程度不一,可累及皮肤、消化、呼吸等多个系统,易与新生儿坏死性小肠结肠炎(NEC)、败血、喂养不耐受等混淆。中华医学会儿科学分会新生儿学组和中华儿科杂志编辑委员会组织制订“新生儿牛奶蛋白过敏诊断与管理专家共识(2023)”,旨在对新生儿CMPA的临床特点、诊断与鉴别诊断、治疗与预防给予相应的推荐意见。
本文仅对共识推荐意见部分进行阐述。
新生儿CMPA推荐意见
(一)新生儿CMPA症状识别
推荐意见1:新生儿CMPA主要为非IgE介导类型,其临床表现多样且无特异性,多以血便起病,也有呕吐、腹胀、腹泻等症状,应及时识别并判断病情轻重,以便进一步管理和治疗。
新生儿CMPA的主要类型为非IgE介导,通常发生在摄入过敏原2 h后,一般为6~72 h,为迟发型过敏反应。临床症状多样,常累及多个系统,可表现为食物蛋白诱导的过敏性直肠结肠炎、食物蛋白诱导性小肠结肠炎综合征、食物蛋白诱导性肠病和Heiner综合征等。最常见的类型是食物蛋白诱导的过敏性直肠结肠炎,目前虽未见新生儿期发生食物蛋白诱导性肠病的报道,但早产是其高危因素之一。IgE介导的CMPA在新生儿期极为罕见,仅有个案报道,表现为荨麻疹和过敏性休克;IgE和(或)非IgE共同介导的CMPA在新生儿时期仅有特应性皮炎,可表现为非湿疹样表现、独立的湿疹样表现及混合型表现且不只局限于皮肤症状。
1.食物蛋白诱导的过敏性直肠结肠炎:为远端结肠对食物蛋白的炎症反应,由炎症细胞浸润造成肠上皮细胞的破坏。通常见于足月儿,多于出生后2~6周时出现症状,母乳喂养者平均发病时间晚于配方喂养者。患儿一般状态良好,首发症状为血便,特征性表现为粪便中带新鲜血丝、血点或血性黏液,亦可出现呕吐、腹胀、腹泻等。食物蛋白诱导的过敏性直肠结肠炎多于婴儿期后期自行缓解,严重贫血及生长受限相对少见,但可能出现由长期慢性出血导致的轻度贫血。
2.食物蛋白诱导性小肠结肠炎综合征:由食物抗原特异性T细胞活化增强所致,活化的T细胞分泌细胞因子,破坏肠道屏障,进一步增加对抗原的暴露,典型症状为急性食物蛋白诱导性小肠结肠炎综合征反应。患儿通常在接触变应原后1~4 h内出现反复呕吐、嗜睡和苍白,同时伴随脱水或腹泻,腹泻呈水样便(偶尔为黏液血便),部分患儿出现低血压,严重者可出现低体温、代谢性酸中毒等。长期持续暴露于变应原导致的慢性食物蛋白诱导性小肠结肠炎综合征表现为慢性腹泻、生长受限以及中到重度的频繁呕吐。患儿若全身症状重且发生严重血便、腹胀等消化道症状,需要与败血症或NEC等疾病进行鉴别。
3.Heiner综合征:较为罕见,表现为食物过敏导致的反复肺部浸润、生长受限、含铁血黄素沉着和贫血,Ortega-Espinosa等报道1例以呕血为主要症状的1月龄患儿,在规避牛奶蛋白后症状明显好转。
推荐意见2:鉴于早产儿消化系统和免疫系统尚未发育完善,与足月儿相比,多数情况下早产儿发生CMPA时间更晚,症状更复杂,病情更严重,更易发生食物蛋白诱导性小肠结肠炎综合征,应重视与NEC等疾病鉴别。
Miyazawa等和Morita等发现,在多个新生儿重症监护病房中,CMPA病例中低出生体重儿占41%,表明早产儿CMPA发病率并不低且与足月儿发生CMPA的高危时间不同,足月儿发病中位年龄为3.5 d,而早产儿为23 d。另外,出生体重越低的患儿,发病时间越晚。造成这种情况的主要原因有两个方面:一是喂养不当、肠道缺血等因素导致不成熟的肠上皮损伤;二是食物过敏所需的Th-2型免疫反应在早产儿校正胎龄30~32周才发育成熟,但也有早产儿出现早发型CMPA的个案报道。这可能与羊水中的牛奶蛋白抗原穿过胎盘引起胎儿宫内致敏有关。足月儿和早产儿发生CMPA多为非IgE介导,但两者的临床表现和严重程度有所差异。足月儿通常表现为食物蛋白诱导的过敏性直肠结肠炎,其临床表现较为单一,可能仅为血便,也可能伴全身症状,Siu等报道了1例出生胎龄37周足月儿于13日龄出现严重腹泻、酸中毒及休克等症状。早产儿的临床症状则不典型,单纯为血便较少,更可能表现为食物蛋白诱导性小肠结肠炎综合征,病情较为严重,甚至可能出现类似于NEC、败血症或休克的症状。
(二)新生儿CMPA诊断与鉴别
推荐意见3:多种婴幼儿CMPA的筛查和诊断方法如外周血嗜酸性粒细胞、过敏原皮肤点刺试验、血清IgE检测等,由于局限性不能广泛应用于新生儿。新生儿期CMPA主要依靠过敏高危因素、临床症状与摄食关系、诊断性回避试验效果以及排除其他相关疾病进行综合分析诊断,应根据临床严重程度采取有区别的诊断流程(图1)。
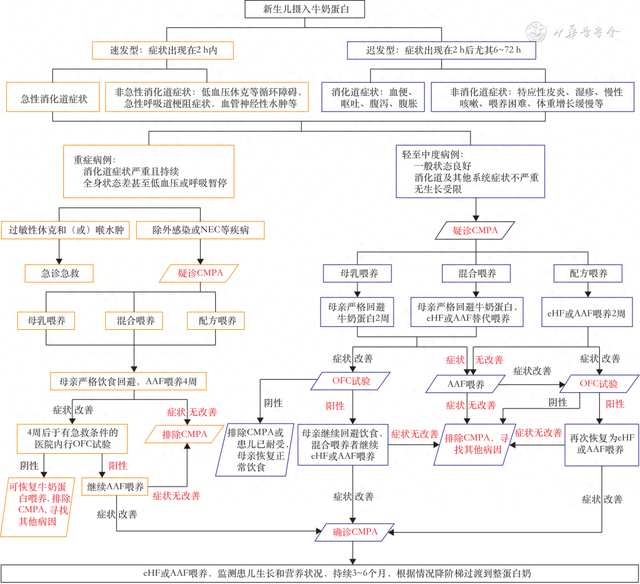
▲图1 新生儿CMPA诊断与管理流程图
1.诊断性回避试验:当患儿出现疑似CMPA症状时,若母乳喂养则母亲回避含牛奶蛋白的食物,若牛奶配方喂养则根据病情严重程度选择深度水解配方(extensively hydrolyzed formula,eHF)或氨基酸配方(amino acid formula,AAF)回避,CMPA新生儿的临床症状通常在回避后3~4 d明显缓解,2~4周消失。重度CMPA患儿直接选择AAF诊断性回避,但考虑到轻中度CMPA的婴儿仍然存在一定比例对eHF不耐受,而AAF是无敏配方,也可以在诊断性食物回避期间考虑直接使用AAF替代。
2.口服食物激发(oral food challenge,OFC)试验:双盲、安慰剂对照的OFC测试是诊断CMPA的金标准。对于轻中度的CMPA患儿可以考虑OFC。但新生儿CMPA主要为非IgE介导的迟发型过敏反应,采用OFC试验诊断时可能遗漏症状导致误诊、漏诊;另一方面由于费时、费力、家长依从性差且存在使新生儿病情恶化的潜在风险,新生儿不常规应用,尤其应避免用于基础状态差的新生儿和肠道及免疫系统发育不成熟的早产儿。
3.腹部超声:虽然超声的无创性与简便性可辅助新生儿CMPA与NEC进行鉴别诊断,但新生儿非IgE介导的CMPA腹部超声表现与NEC腹部超声表现有重叠,如肠壁增厚、肠系膜增厚、腹腔积液、肠蠕动异常等,还可出现肠管扩张、门静脉积气等严重表现。Guo等发现CMPA的超声表现为病变区肠管蠕动消失,病变区以外的肠段蠕动正常甚至增强,而NEC患儿病变部位外的肠段蠕动亦有减弱,甚至表现为全腹部的肠动力减弱或消失,动态监测CMPA患儿在禁食或食物回避后恢复较快。由于超声诊断具有主观性,其对CMPA的诊断仍需有经验的医生结合临床识别。
推荐意见4:新生儿CMPA以消化系统症状为主要临床表现,通常表现为血便、腹胀、呕吐等,需与NEC、感染性肠炎、胃肠道畸形、乳糖不耐受、胃食管反流病、其他直肠及肛门出血性疾病相鉴别。
1.NEC:食物蛋白诱导性小肠结肠炎综合征在急性期与NEC相似,故诊断食物蛋白诱导性小肠结肠炎综合征需首先排除NEC。若患儿有过敏性疾病家族史、牛奶蛋白摄入史且回避牛奶蛋白症状得到缓解,均提示CMPA可能。同时,还需结合临床特征、辅助检查等进行鉴别。在临床症状方面,食物蛋白诱导的过敏性直肠结肠炎是自限性疾病,一般状态往往良好,可出现血便和腹胀,而NEC全身症状更重,可出现活动减少、反复呕吐、皮肤苍白、休克以及水样或血性腹泻等严重表现,体格检查有腹膜炎体征;实验室检查方面,NEC患儿一般出现白细胞比例减少或血小板减少及急性炎症因子升高,而CMPA患儿嗜酸性粒细胞以及血小板计数升高;影像学方面,二者均会出现肠壁积气,但NEC会出现肠梗阻、肠穿孔等严重表现,这种差异在足月儿中较为明显,但在早产儿中差异不大,可能导致误诊。国内外学者探讨用腹部超声鉴别二者,发现早产儿食物蛋白诱导性小肠结肠炎综合征及NEC可出现肠壁积气、门静脉积气改变,但NEC时会出现弥漫性的肠道蠕动变弱或消失,而CMPA仅累及局部肠袢,受累肠道以外的肠道可表现为蠕动正常甚至增加。禁食或食物回避后,CMPA患儿肠壁积气、门脉积气、肠蠕动恢复较快。
2.感染性肠炎:新生儿尤其是足月儿CMPA需与感染性肠炎鉴别。在临床症状方面,感染性肠炎患儿常出现发热和腹泻,病原学可能为细菌、病毒或真菌。病毒感染多为水样腹泻,细菌感染多为脓或脓血便。CMPA一般不发热,牛奶蛋白致敏史也有助于鉴别诊断。实验室检查方面,感染性肠炎患儿白细胞可升高或明显降低,CMPA患儿白细胞多正常或轻度升高;粪常规及细菌培养或病毒分离也有助于区分二者。
3.胃肠道畸形:对于出现严重血便或腹胀及喂养不耐受的患儿,应与新生儿期出现的消化道畸形如肠套叠、肠旋转不良、肠扭转、肠闭锁、先天性巨结肠等相鉴别,后者腹部X线、消化道造影或胃肠道超声可见到相应形态及结构异常。
4.其他引起肠道出血性疾病:根据出血的程度可进行鉴别诊断。严重的出血除外科疾病外,注意排除凝血障碍和血小板减低症等;轻度至中度出血注意排除肛门局部皮炎、肛裂或局部感染。例如,新生儿肛裂患者常合并便秘,查体可见肛周皮损。
5.乳糖不耐受:是由乳糖酶绝对或相对缺乏导致的疾病,其特点是摄入乳糖后出现以腹泻为主的消化道症状,而超早产儿更多表现为腹胀。腹泻性质多为黄绿色的稀水样糊状便,有酸臭味。乳糖不耐受与CMPA临床表现相似,部分患儿可能混合发病。由于母乳中乳糖含量明显高于牛乳,乳糖不耐受在母乳喂养者中更常见。通过粪便还原糖测定及无乳糖配方试验性治疗等可鉴别。
6.胃食管反流病:非IgE介导的CMPA可能出现类似胃食管反流症状,但是新生儿进行上消化道内镜、食管下括约肌压力测定、食管pH值监测以及OFC试验都较为困难,使得CMPA与胃食管反流病不易鉴别。内镜检查、食管测压和pH监测结果正常也无法完全排除非糜烂性胃食管反流病。建议在排除器质性疾病及其他严重疾病的前提下,常规治疗无效时先进行诊断性饮食回避试验及OFC试验。在此过程中实时评估CMPA风险,若症状不改善可进一步行内镜检查,结果阳性或反流症状持续时进行抗酸治疗。
(三)新生儿CMPA饮食管理
推荐意见5:母乳喂养新生儿发生牛奶蛋白过敏时建议继续母乳喂养,母亲严格回避含牛奶食品,并补充钙及维生素D制剂,如果出现严重过敏症状,选择AAF或eHF喂养。
对于考虑CMPA的新生儿,应当鼓励继续母乳喂养,同时母亲需回避含牛奶蛋白的食物2~4周。若因各种原因无法完全纯母乳喂养需混合喂养时,建议临床症状不重的CMPA患儿可选择PHF或eHF喂养。但当患儿出现以下情况时需暂停母乳,选择AAF替代喂养:(1)严重过敏症状,如严重的特应性皮炎,过敏性肠炎合并生长迟缓和(或)低蛋白血症和(或)严重贫血,嗜酸性粒细胞性食管炎等;(2)母亲严格回避饮食或母乳与eHF混合喂养2周后,患儿症状无明显改善;(3)母亲饮食回避后严重影响母亲身心健康。
既往国际推荐在母乳回避饮食无效时首选eHF替代喂养。然而,最新研究发现,在纯母乳喂养婴儿出现过敏症状时,eHF仍不能耐受,AAF总体获益可能优于eHF。对于上述情况暂停母乳喂养,母亲回避含牛奶食物2~4周后可再次母乳喂养。但如果过敏症状仍然复发,应考虑继续采用低敏配方替代喂养。如果母亲回避饮食后患儿症状改善,可在母亲每周的饮食中重新引入牛奶食物。如果症状未再出现,母亲则可停止饮食回避,如果症状再次出现,则应在哺乳期间持续饮食回避。母亲长期回避饮食情况下,建议母亲同时补充钙剂及维生素D制剂。
推荐意见6:配方喂养新生儿发生牛奶蛋白过敏时推荐采用eHF或AAF喂养。
配方喂养新生儿发生CMPA时,国际指南建议轻至中度临床表现的患儿首选eHF替代喂养。然而,在以下情况,可能需考虑更换为AAF喂养:(1)eHF治疗不耐受、2~4周症状无好转;(2)患儿出现严重过敏症状,如严重的特应性皮炎、过敏性肠炎合并生长迟缓和(或)低蛋白血症和(或)严重贫血、嗜酸性粒细胞性食管炎等;(3)母亲及家人极其焦虑无法接受任何潜在的过敏风险。
研究显示,eHF喂养时仍有2%~10%非重症患儿可能无法耐受,需更换为AAF喂养,另有研究报道,对于eHF不耐受的患儿,AAF喂养能更好缓解过敏症状并改善生长。周慧君等从卫生经济学评价指出相较于eHF,起始使用AAF替代喂养对于我国CMPA患儿治疗具有一定的经济学优势。使用eHF或AAF替代喂养2~4周后,如患儿症状改善,应根据病情进行OFC试验。若症状再次出现,应继续eHF或AAF替代喂养至少3~6个月。如果替代喂养后,患儿的过敏症状无缓解或OFC试验呈阴性,则应排除新生儿CMPA,寻找其他病因。
(四)新生儿CMPA营养管理
推荐意见7:对于牛奶蛋白过敏新生儿,尤其是早产儿、低出生体重儿及小于胎龄儿,应定期进行生长和营养评估,个性化补充相应营养素。
早产儿、低出生体重儿、小于胎龄儿等存在营养高风险的患儿在合并有CMPA时,肠道吸收功能降低,营养需求量相对增加。在奶量充足的情况下,母乳、eHF、AAF等能够满足患儿的生理需求,但对存在营养高风险的患儿来说可能存在蛋白质等营养素供应不足情况。
对于母乳喂养且合并有CMPA的营养高风险患儿,如有生长不良,可根据肠道耐受情况,对于出生胎龄<34周早产儿考虑添加母乳强化剂增加能量和蛋白质等营养素摄入。在母乳强化剂的选择上,相较于牛乳来源的非水解的母乳强化剂,人乳来源的母乳强化剂可以大幅度改善早产儿的胃肠道症状(包括牛奶蛋白过敏)。然而,我国仍无法获取人乳来源的母乳强化剂,故CMPA的早产儿应谨慎使用非水解的母乳强化剂。
最新研究发现,深度水解的母乳强化剂不增加过敏发生率,对于母乳喂养的CMPA患儿,如果存在生长不良可以考虑选择。对于eHF、AAF喂养的CMPA患儿,建议婴儿配方的渗透压不应超过400 mOsm/L(即450 mOsm/kg H2O),常用的eHF和AAF均低于该推荐值。部分患儿在奶量足够的前提下仍存在生长不良,在保证提高eHF渗透压仍在安全范围的前提下,可以考虑提高eHF浓度以提高能量密度改善生长不良。
母乳以及目前中国市场上eHF、AAF中的部分营养素并不能完全满足营养高风险患儿需求,因此,对于CMPA的营养高风险患儿,除需按照生理需要量予以补充维生素D、钙、磷等矿物质外,还需注意因储备及摄入不足、并发症等所致各种营养素的缺失,予以个性化补充。针对营养高风险新生儿,应密切监测新生儿血清25-羟基维生素D、钙磷浓度、碱性磷酸酶、电解质、血红蛋白等指标,必要时还需监测血清微量元素、铁蛋白、铜蓝蛋白、甲状腺素水平,了解新生儿营养状况并补充各类外源性营养素,以免影响生长发育,并实施全面营养管理。
(五)新生儿CMPA预防措施
推荐意见8:鉴于母乳喂养对母子双方的健康效应,避免生后早期引入含牛奶配方,可降低牛奶蛋白过敏风险。
母乳蛋白质为同种蛋白质,而且存在少量来自母亲的食物特异性抗原,如卵清蛋白、β-乳球蛋白、麦醇溶蛋白及花生等,可适当刺激婴儿的免疫系统,促进免疫发育和免疫耐受,预防过敏发生。此外,母乳中丰富的低聚糖、分泌性IgA、细胞因子、益生菌等均有助于降低婴儿食物过敏风险。
证据表明,母乳喂养的新生儿在出生后前3 d接触牛奶配方会增加CMPA的风险。因此,在出生后早期避免临时补充牛奶配方可能会大幅降低幼儿期CMPA的风险。母乳喂养的婴儿在出生的最初几天接触牛奶可能会显著增加CMPA的风险。因此,应鼓励新生儿期母乳喂养,避免生后早期引入牛奶配方,以降低过敏风险。在前瞻性队列研究中,研究人员追踪了6 209例纯母乳喂养的婴儿是否发生CMPA,结果显示,在产房暴露于牛奶蛋白是存在牛奶特异性IgE的重要危险因素。母乳喂养的婴儿接受牛奶配方补充(45.8%小于24小时龄的新生儿)患CMPA的风险比纯母乳喂养的婴儿高7.03倍。开放的非盲临床试验中,母乳喂养中添加了AAF的牛奶配方(5 ml/d,直到5月龄),结果发现,在婴儿2岁时有16.8%的婴儿对牛奶(IgE水平>350 U/L)敏感,而母乳喂养-牛奶组的比例为32.2%(RR=0.52,95%CI 0.34~0.81)。Sakihara等的研究表明,31例在出生后3 d内未食用牛奶配方的婴儿,无论他们后来的饮食如何,均未发生CMPA。
推荐意见9:不推荐限制母亲妊娠期、哺乳期牛奶及其制品饮食以预防CMPA。
目前无证据显示母亲在妊娠期回避牛奶和鸡蛋会减少子代过敏性疾病的发生。对于有过敏的高危妇女,在妊娠期间采用抗原回避饮食并不能降低其子女患特应性疾病的风险,而且回避饮食可能对孕产妇和胎儿的营养产生不利影响。虽然有研究表明,在哺乳期对高风险妇女采取抗原回避饮食可能会降低其子代患特应性湿疹的风险,但还需进一步的临床研究证实。
推荐意见10:不推荐母乳喂养新生儿使用pHF预防CMPA,当不能母乳喂养或母乳不足时,过敏高风险的新生儿不推荐使用pHF或eHF降低CMPA风险。
系统综述显示,与整蛋白牛奶配方降低牛奶蛋白过敏风险相比,使用pHF(涉及3 572例婴儿的5项随机对照试验),绝对效果从34%的下降到11%的增加不等。而对于eHF(涉及的3 221例5项随机对照试验),绝对效果从减少4%到2%不等,这表明部分或eHF-乳清(whey,W)或eHF-酪蛋白(casein,C)可能不会降低食物过敏的风险。同样,Cochrane综述也发现,在无法完全母乳喂养的高危婴儿中,没有证据支持使用水解配方喂养可预防CMPA。仅有极低质量证据表明,与牛奶蛋白配方相比,短期使用eHF可预防婴儿期CMPA的风险。另有系统评价显示,与使用牛奶蛋白配方相比,使用pHF(100%乳清)可显著降低高风险儿童过敏性疾病(特别是特应性皮炎或湿疹)的发生率。在这项评价中,对综合结果贡献最大的为德国婴儿营养干预研究(German infant nutritional intervention study,GINI研究),其为大型、设计良好、实施良好的随机对照试验,随访期为20年,试验涉及2 252名健康婴儿,他们被随机分配到3种水解配方中的1种(pHF-W、eHF-W、eHF-C)或基于完整牛奶蛋白的配方作为参考,结果显示,在接受pHF-W或eHF-C与牛奶配方的婴儿中,特应性皮炎的累积发病率降低。此外,在随访16~20年后,在高风险人群中,青春期后哮喘的患病率在eHF-C组和pHF-W组中均较低。
推荐意见11:没有足够的证据显示补充益生菌、益生元或合生元、长链多不饱和脂肪酸、维生素 D能预防CMPA。
益生菌在促进免疫系统及神经系统的发育成熟及产生免疫耐受方面发挥重要作用。有证据显示,母亲在妊娠期或哺乳期应用益生菌可能会降低湿疹的发生率。此外,患儿生后联合应用AAF和益生菌可预防某些过敏症状如过敏性皮炎、反复发作性哮喘及荨麻疹等发作,然而,这些方法均不能减少过敏性疾病的发生。
膳食脂肪酸的摄入可能会影响炎症和免疫耐受反应的发生。有综述指出,母亲在妊娠期或哺乳期补充鱼油可能会降低CMPA发生,然而证据尚不充足。另外,母亲在妊娠期和哺乳期补充维生素D以及婴儿出生后补充维生素D均对过敏反应没有影响。研究表明,维生素D与儿童CMPA发病率呈U型线性关系,CMPA可影响肠道对维生素D的吸收,导致维生素D水平低于同龄正常儿。在一定程度上,维生素D缺乏可增加CMPA的发病率,但过高同样可导致其发病率增加。建议每名婴儿都补充维生素D,但对CMPA的预防作用尚无证据。
总之,新生儿CMPA具有独特的特点,不仅影响消化、皮肤、呼吸等各器官和系统功能,亦影响3岁以下婴幼儿的生长发育。因此,需充分了解新生儿CMPA的高危因素,并早识别、早诊断、早治疗。对于疑似CMPA的患儿,应给予合理的防治;而对于确诊CMPA的患儿,需加强营养管理并动态监测其生长发育。
(韩树萍 武辉 包蕾 冯星 母得志 富建华 史源 周文浩 执笔)
参与本专家共识讨论和修改的专家名单(略):
本文编辑:李伟
