本文来源:中华消化杂志, 2024,44(4) : 217-222.
本文作者:代维 韩国宏
美国肝病学会(American Association for the Study of Liver Disease, AASLD)、欧洲肝病学会(European Association for the Study of the Liver, EASL)和亚太肝病学会(Asian Pacific Association for the Study of the Liver, APASL)将慢性乙型肝炎病毒(hepatitis B virus,HBV)感染患者和任何病因的肝硬化患者定义为肝细胞癌高危人群,推荐每半年进行1次腹部超声检查,联合或不联合血清甲胎蛋白检测,作为肝细胞癌高危人群监测方案。AASLD、EASL和APASL都支持超声监测,但对甲胎蛋白检测的附加价值存在分歧,EASL不推荐甲胎蛋白检测,而AASLD和APASL都推荐甲胎蛋白常规检测。现对2023国际肝癌协会(International Liver Cancer Association,ILCA)肝细胞癌风险分层和监测白皮书有关内容进行编译和汇总。
一、肝细胞癌监测效力和有效性
监测效力指在临床研究的理想环境下能达到的最大预期效果。一项包含18 000余例中国患者的随机对照试验(randomized controlled trial,RCT)研究显示,肝癌监测可使肝细胞癌相关病死率降低37%。然而,该研究对象为HBV感染人群,结果是否适用于肝硬化人群尚不清楚。因为肝脏结节可能影响超声对早期肝细胞癌的灵敏度,而且肝硬化患者肝病相关病死率的竞争风险更高。ILCA单一主题研讨会(single topic workshop, STW)表示,肝硬化患者肝细胞癌监测的效力仍需要更多高质量证据支持。
监测有效性指在临床实践中能达到的真实效果。在临床中,癌症筛查计划的效果和生存获益取决于筛查工具的检测性能和使用率。虽然超声对不同分期肝细胞癌的灵敏度均可接受,但其对早期肝细胞癌的灵敏度仅为47%(95%置信区间33%~61%)。超声易受检查者技术、患者肥胖和肝病严重程度的影响,近年非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)相关肝细胞癌病例增加,而超声对肥胖和非病毒性肝病患者的灵敏度低。此外,相比于其他癌症筛查手段(如钼靶、结肠镜),肝细胞癌超声筛查完成率低,仅<1/4的肝硬化患者坚持每半年1次腹部超声筛查。肝细胞癌监测过程中还存在几处薄弱环节,导致监测不力(图1)。目前肝细胞癌筛查面临以下阻碍。①医师层面,包括不了解最新指南、看诊时间短、其他更重要的临床问题分散精力;患者层面,包括时间、费用、交通等。②一些有前景的低成本措施,如对患者进行宣传教育、信息提醒、提供交通导航等,可提高筛查完成率,但其有效性和可持续性尚未在大规模人群中得到验证。③虽然筛查工具的进步可能会改善部分问题,但识别高危个体并提供筛查手段仍是薄弱环节和未来干预的关键点。

▲图1 肝细胞癌监测过程中可能导致监测不力的薄弱点
二、肝细胞癌的风险分层
肝细胞癌监测具有成本效益,推荐对肝细胞癌高风险人群实施监测策略,其风险程度可根据年发病率来定义。决策分析表明,非肝硬化HBV感染患者肝细胞癌风险阈值>0.2%/年,肝硬化患者>0.8%/年,证明基于超声监测的合理成本效益阈值为10 000美元/质量调整生命年。活动性丙型肝炎病毒(hepatitis C virus, HCV)相关性肝硬化的肝细胞癌年发病率为3%~5%,而HCV治愈后肝硬化或NAFLD相关肝硬化的肝细胞癌年发病率为1%~2%。由于全球肥胖的流行和抗病毒药物的广泛应用,肝细胞癌的主要病因正由病毒性肝病向代谢性肝病转化,因此,确定理想监测人群越来越难。
肝细胞癌发病率的降低增加了需筛检人数,由此降低了监测效果。筛查带来的身体、经济或心理上的潜在危害会涉及所有监测人群,但获益仅限于最高风险人群。因此,不同风险分层肝硬化患者肝细胞癌监测价值的差异很大。研究表明,NAFLD相关肝细胞癌患者中20%~30%无肝硬化,而且非肝硬化NAFLD患者肝细胞癌年发病率极低。据一项退伍军人事务卫生系统的大型研究报道,非肝硬化NAFLD患者肝细胞癌年发病率仅0.08/1 000人年。然而,大多数非肝硬化NAFLD患者肝细胞癌风险的数据来自回顾性队列研究,而且这些患者未纳入监测计划,因此,目前真正的发病风险尚不明确。如果所有非肝硬化NAFLD患者都纳入监测,将扩大目标人群,加重监测负担。这些问题体现了"一刀切"监测模式的局限性,以及风险分层的必要性。
文献中已报道了许多肝细胞癌风险预测模型(表1),但大多数模型代表特定病因和(或)种族(民族),在应用前需要外部验证。近年来,非临床变量及多模态整合(如影像组学)热度逐年上升。种系单核苷酸多态性(如PNPLA3)与肝硬化患者肝细胞癌风险增加有关。肝脏组织学和血液学分子特征、病原学特征(如微生物组学、病毒组学)、体细胞突变特征也与肝细胞癌风险增加有关。这些特征相较于临床变量的增量价值,以及实施的难易程度等,仍需要数据证实。从方法学的角度出发,大多数临床风险预测模型都是传统的回归模型,最近研究显示,人工智能或深度学习的建模方法很有前景。

三、新兴肝细胞癌监测策略
鉴于超声监测的局限性,新兴血液学和影像学监测策略引起研究人员广泛关注(表2)。一些生物标志物已经在Ⅱ期临床研究中崭露头角,如GALAD模型——基于性别、年龄、甲胎蛋白异质体-3、甲胎蛋白和异常凝血酶原的预测模型,在一项跨国Ⅱ期生物标志物研究中显示该模型的灵敏度为60%~80%,另一项由早筛研究网进行的大型Ⅲ期队列研究显示该模型的灵敏度和特异度分别为65%和82%。

早期肝细胞癌的监测正逐步向液体活体组织检查(以下简称活检)和简化磁共振成像(magnetic resonance imaging, MRI)等现代化监测手段过渡。液体活检指肿瘤成分分析,如循环肿瘤DNA(circulating tumor DNA,ctDNA)、循环肿瘤细胞(circulating tumor cell, CTC)、细胞外囊泡(extracellular vesicle, EV)。早期肝细胞癌的液体活检主要指ctDNA甲基化、ctDNA突变、非编码RNA和CTC检测。液体活检应用的主要阻碍是ctDNA仅占循环DNA的2%,在早期阶段甚至更少,因此,难以识别且易出现检测错误。
从影像学角度来看,断层影像具有良好的灵敏度和特异度。两项单臂队列研究显示,计算机断层扫描(computed tomography, CT)和MRI对早期肝细胞癌检出的灵敏度较超声高(83%比29%,86%比28%),特异度相当。然而,两项研究均在亚洲HBV感染人群中开展,仍需要在不同病因的西方人群中进行验证,且CT具有辐射和肾毒性,MRI花费高、开展能力受限。目前,简化MRI正逐步替代MRI,无论是对比剂增强简化MRI还是非对比剂增强简化MRI,都能在15 min内获得有限序列,检出率高。近期一篇纳入15项研究的meta分析显示,非对比剂增强简化MRI的综合诊断性能与对比剂增强简化MRI相似(灵敏度86%比87%,特异度94%比94%),但该meta分析存在一些局限,即大多为回顾性研究、目标人群选择欠佳、缺乏与超声的对比。目前正在开展的几项RCT研究解决了这一问题,包括FASTRAK研究、MAGNUS-肝细胞癌研究和MIRACLE-肝细胞癌研究,均比较了简化MRI与超声在肝细胞癌高危人群中的作用(NCT05095714)。
四、肝细胞癌监测策略的临床验证与临床实用性
先前的ILCA白皮书详细介绍了生物标志物验证的5个阶段,包括临床前生物标志物的发现(第Ⅰ阶段)、病例对照样本的早期验证(第Ⅱ阶段)、使用PRoBE(即前瞻性标本收集、回顾性盲法评估)设计的回顾性队列验证(第Ⅲ阶段)、生物标志物检测性能的前瞻性队列验证(第Ⅳ阶段)、进行RCT确定是否能降低临床病死率或具备可观的获益/危害比(第Ⅴ阶段)。
Ⅳ、Ⅴ阶段的研究通常基于Ⅱ、Ⅲ阶段的研究数据。Ⅳ、Ⅴ阶段试验成本高昂且耗时,使新型生物标志物的应用延迟,但Ⅳ、Ⅴ阶段临床验证决定了其检测性能(即灵敏度和特异度)是否优于超声联合甲胎蛋白或单纯超声。相反,临床实用性评价需要Ⅳ、Ⅴ阶段研究提供设计和框架,以评价重要临床结局,包括方案调整、根治性治疗的接受、肝细胞癌相关病死率、质量调整生命年、筛查相关危害(如假阳性或不确定结果、过度诊断)。
五、肝细胞癌精准监测
精准医学概念主要应用于癌症治疗。为优化筛查策略,该概念在癌症筛查中的应用越来越广泛。精准监测可解决当前监测算法的缺陷,如肝细胞癌风险的半定量评估能根据个体风险水平制定个体化策略(图2):即肝细胞癌风险分层应基于临床、分子和(或)其他生物学特征的综合评分系统,并需区分是否存在进展性慢性肝病(advanced chronic liver disease, ACLD)和(或)肝硬化。对于ACLD和(或)肝硬化患者,高风险个体应使用高效早筛工具和(或)缩短筛查间隔(筛查干预1),中风险个体使用不太复杂和昂贵的筛查工具,并定期重新评估风险分层(筛查干预2)。对于非ACLD和(或)肝硬化患者,绝大多数不纳入监测计划,极少数肝细胞癌高危人群,可采用筛查干预3。理论上,肝细胞癌精准筛查理念可提高监测可行性、患者接受度和成本效益。但有以下几项要求:①准确评估风险人群中个体的肝细胞癌风险;②制定风险阈值,将人群分层为不同的风险组;③根据风险组调整监测策略。实现精准筛查可能需要临床、生物学和(或)影像学数据整合而成的综合算法。机器学习和人工智能可处理多种来源的复杂数据,推动精准监测的发展。

注:ACLD为进展性慢性肝病。筛查干预1指高风险个体应使用高效早筛工具和(或)缩短筛查间隔;筛查干预2指中风险个体使用不太复杂和昂贵的筛查工具,并定期重新评估风险分层;筛查干预3指对不进行常规监测的患者中极少数肝细胞癌高危人群进行筛查
▲图2 肝细胞癌精准筛查理念
肝细胞癌风险在ACLD和(或)肝硬化与非ACLD和(或)肝硬化人群中大不相同。虽然精准筛查主要针对ACLD和(或)肝硬化患者,但对其他人群而言,难点在于识别高风险个体。此外,有可能可以确定极低风险的ACLD和(或)肝硬化患者亚组,从而豁免监测,这类人群可能与HBV控制或丙型肝炎治愈有关。
早癌风险分层将引出很多问题:ACLD和(或)肝硬化患者与其他人群相比,应该考虑哪些风险因素(或分层模型),阈值如何确定,应该设计多少个风险组,应该在哪个时间点进行风险评估,多久进行1次监测,对最低或最高风险的个体采用哪些干预。美国一项调查研究建议,临床医师应接受基于风险分层的精准监测策略,哪怕不愿放过低风险个体。尚需要研究来确定各种监测方法在每个风险群体中的相对有效性,如肥胖和严重肝功能障碍都是肝细胞癌的危险因素,但对监测性能的影响不同。肥胖降低超声灵敏度,而Child-Pugh B级肝硬化降低简化MRI灵敏度,GALAD模型在女性群体中的监测性能似乎不佳。最终,还要考虑这些策略如何在临床中实施。虽然精准监测策略比超声监测准确性高,但由于操作复杂性和医师疑惑增加,由此导致依从性降低,使其准确性可能无法达到预期。
六、肝细胞癌监测策略的商业化及其对转化的影响
ILCA STW最后进行了一场会议,邀请行业合作伙伴发表其对生物标志物开发和验证的看法。该环节特别提出了验证阶段的阻碍及与学术界合作的潜在机会,旨在促进生物标志物更快转化应用(图3)。
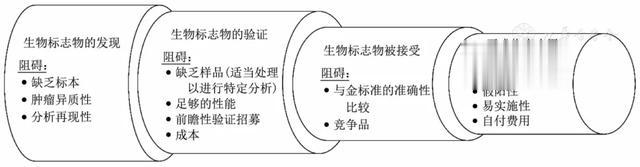

▲图3 生物标志物转化应用的流程和阻碍
关于商业界与学术界合作的探讨主要是意识到一些有前景的风险分层和监测策略转化比预期慢、成本高。据估计,生物标志物的开发和验证将耗资1 000万~5 000万美金,耗时8~10年才能进入市场。不同于药物开发,生物标志物开发的投资可能需要更长时间才能收回成本。为了加快生物标志物的开发和验证,一些企业在Ⅱ期临床试验验证后开始招募大量肝细胞癌高风险患者,将腹部MRI或CT作为金标准,比较新型生物标志物与腹部超声的性能(NCT 03694600和NCT 05064553)。虽然这些大型横断面研究可以提供生物标志物的性能数据(相比于标准监测策略),但其纵向特点、假阳性率和不确定结果仍不明确。医疗保健付费方(医疗保险和医疗补助中心或欧洲药品管理局)批准这些生物标志物可能面临较大的压力,这些研究涉及的生物标志物能否获得批准尚不得而知。
目前,已有大量资金投入大规模前瞻性队列研究,如早期检测研究网络(Early Detection Research Network)组织的肝细胞癌早诊策略和德克萨斯州肝细胞癌联盟,建立了生物样本库,用于肝细胞癌风险分层的Ⅲ期临床试验验证或生物标志物早期发现。生物样本库有利于蛋白质生物标志物的发现,但对液体活检分析物(如CTC和EV)的发现具有难度。由于EV体积小、物理化学性质独特,缺乏高效可持续的分离纯化EV的技术,这一直是EV作为癌症生物标志物的主要障碍。因此,现有的大型样本库可能无法实现检测液体活检分析物,就需要企业开发前瞻性队列研究进行Ⅲ期临床试验验证,这增加了资金和时间投入。同样的原因也影响了影像学领域对早期肝细胞癌的研究,因为许多现有的生物样本库并不常规获取影像学资料。如果常规获取影像学资料,将会挑战影像学领域新技术(如简化MRI、MRI指纹识别)在肝细胞癌监测中的特殊地位。因此,开发大型、标记良好的影像数据库也非常必要。
基于血液学的多肿瘤标志物试剂盒正备受关注,目前处于Ⅱ期临床试验验证阶段。这种试剂盒通常由几家企业共同开发,通过1次血液检测筛查出多种肿瘤。虽然血液检测筛查较方便,但其负面影响可能很大,因为在癌症低风险人群中,假阳性率可能高于真阳性率,由此带来的诊断性检查将引起伦理和费用问题。如果对算法进行校准使其假阳性率最小化,真阳性率则会受到影响。由于利益竞争,肿瘤标志物试剂盒可能在尚未获得充分验证时面向消费者直接营销。因此,应倡导学术界与产业界的合作,确保肿瘤标志物试剂盒性能得到充分验证,并用于目标人群,实现受益最大化和危害最小化。多肿瘤标志物试剂盒大有前景,但在利用和纳入筛查指南前,必须解决上述问题。
七、结论和展望
无论是否联合甲胎蛋白检测,腹部超声仍然是当前肝细胞癌筛查的金标准。然而,超声很难降低肝细胞癌病死率,这是由于超声难以充分识别高危个体、使用不充分、监测模式性能欠佳。这些问题凸显了对新风险分层和新型生物标志物的迫切需求。一些新兴的影像学或血液生物标志物已在Ⅱ、Ⅲ期临床试验验证中展露出前景,但在应用于临床前,需要在Ⅳ、Ⅴ期临床试验中进一步验证。
为解决协调安排、花费和时间限制等问题,从而充分有效地验证新风险分层和监测策略,ILCA STW强调学术界与产业界的合作并开展创新型研究。由此将推动精准筛查策略,加速监测策略的转化,提高肝细胞癌的早期诊断,降低肝细胞癌相关病死率。
本文编辑:张晶
