作者:范盛心 蔡奇宴 王晓慧 李琦 陈虹
单位:重庆医科大学附属第一医院呼吸与危重症医学科;重庆医科大学附属第一医院放射科
引用本文: 范盛心, 蔡奇宴, 王晓慧, 等. 低剂量抗凝成功治疗高危肺栓塞1例 [J] . 中华结核和呼吸杂志, 2024, 47(5) : 450-454. DOI: 10.3760/cma.j.cn112147-20231102-00284.

摘要
再灌注治疗被认为是治疗高危肺栓塞的基石,然而当合并溶栓禁忌且无法进行外科或介入干预时,高危肺栓塞的治疗就显得十分棘手。目前尚未见关于使用低剂量抗凝成功救治高危肺栓塞的报道。2021年11月30日重庆医科大学附属第一医院急诊科收治1例56岁男性自发性动脉瘤性蛛网膜下腔出血患者,因存在手术指征转入神经外科。入院第2天,在进行动脉瘤夹闭术过程中患者突发休克,完善D-二聚体、心肌损伤标志物、超声心动图、计算机断层扫描肺动脉造影等检查后考虑高危肺栓塞。因患者合并溶栓禁忌,且拒绝行介入治疗,最终通过低剂量抗凝联合血管活性药物成功将其治愈。
正文
高危肺栓塞主要表现为右心功能障碍及血流动力学紊乱,占所有类型肺栓塞的3.1%~4.4%[1, 2, 3]。再灌注治疗指通过溶栓药物、介入治疗或手术治疗,使闭塞的血管重新开通、缺血组织获得再灌注的方法,是治疗高危肺栓塞的基石。2019年欧洲心脏病协会(European society of cardiology,ESC)[4]推荐对高危肺栓塞进行系统性溶栓,如果存在溶栓禁忌,可考虑行外科(1C)或介入(2C)取栓术。然而,当合并溶栓禁忌且无法进行介入或外科干预时,高危肺栓塞的治疗就显得非常棘手。由于缺乏随机对照试验,对高危肺栓塞患者仅行抗凝治疗而不使用再灌注治疗是存在争议的。现报道1例高危肺栓塞患者的早期抗凝治疗策略及其临床转归。据了解,目前尚无关于使用低剂量抗凝成功救治高危肺栓塞的报道。
临床资料 患者男,56岁,5 d前因“突发头痛伴头晕”于当地医院完善头颅CT后考虑“蛛网膜下腔出血”,于2021年11月30日18:28紧急转入重庆医科大学附属第一医院。患者既往有高血压病史1年,否认血栓栓塞及凝血功能障碍病史。入院体检:血压:176/88 mmHg(1 mmHg=0.133 kPa),意识Ⅱ级,GCS评分13分,改良Fisher Ⅱ级,Hunt-Hess评分2分,NIHSS评分1分。辅助检查:头颅CTA提示:蛛网膜下腔出血伴右侧颞叶血肿形成(图1A);右侧大脑中动脉M2段动脉瘤(图1B)。患者入院时血常规、肝肾功、凝血功能、D-二聚体、心肌损伤标志物及四肢静脉超声均无明显异常。入院诊断:右侧大脑中动脉M2段动脉瘤,自发性蛛网膜下腔出血。
 图1 患者入院时头颅CT及动脉造影结果,1A为蛛网膜下腔出血伴右颞叶血肿形成;1B为右侧大脑中动脉动脉瘤(白色箭头)12月1日14:00,患者于全身麻醉下行动脉瘤瘤颈夹闭术+血肿清除术,17:45在自体血回输过程中,患者血压及呼气末二氧化碳分压进行性下降,给予去甲肾上腺素0.3 μg·kg-1·min-1泵入、加快静脉补液以维持循环,17:50手术结束,18:00患者血压及呼气末二氧化碳分压分别降至37/28 mmHg、8 mmHg,心率63 次/min,呼吸16次/min(呼吸机固定参数),动脉血气分析(FiO2=60%):pH值为7.57,PaO2 66 mmHg,PaCO2 16 mmHg,HCO3-14.7 mmol/L,立即停止输注自体血,调整去甲肾上腺素泵入剂量至0.5 μg·kg-1·min-1,给予阿托品0.5 mg维持循环,18:01患者皮肤发绀,脉搏氧饱和度降至77%,立即启动心肺脑复苏,并先后给予肾上腺素50 μg、肾上腺素30 μg静脉推注,18:04心电图提示室颤,立即给予电除颤,18:07患者血压、心率、脉搏氧饱和度和呼气末二氧化碳分压分别升至131/80 mmHg、143次/min、100%、33 mmHg,心电图提示恢复窦性心律,遂停止心肺复苏,继续去甲肾上腺素0.03 μg·kg-1·min-1泵入维持循环。术中出血600 ml,累计输注晶体2 700 ml、胶体1 000 ml、自体血280 ml。待患者生命体征平稳后急查血常规:血红蛋白114 g/L,血小板174×109/L;凝血功能:PT 23.9 s,APTT 64.7 s,TT 39.5 s,Fig 0.66 g/L,D-二聚体>76 mg/L FEU,凝血因子活性(表1);肌钙蛋白T 0.191 μg/L,NT-proBNP 388 ng/L。经食道超声心动图(床旁急诊超声,未采集图片)提示心包少量积液,二尖瓣及三尖瓣轻度反流。计算机断层扫描肺动脉造影(computed tomography pulmonary angiogram,CTPA)提示:右肺动脉主干及双肺动脉主要分支多发肺栓塞伴右室增大(图2)。床旁四肢静脉超声提示:未见明显血栓形成。后续查抗凝血酶Ⅲ、蛋白C、蛋白S、抗核抗体谱及抗中性粒细胞胞质抗体谱均无明显异常。
图1 患者入院时头颅CT及动脉造影结果,1A为蛛网膜下腔出血伴右颞叶血肿形成;1B为右侧大脑中动脉动脉瘤(白色箭头)12月1日14:00,患者于全身麻醉下行动脉瘤瘤颈夹闭术+血肿清除术,17:45在自体血回输过程中,患者血压及呼气末二氧化碳分压进行性下降,给予去甲肾上腺素0.3 μg·kg-1·min-1泵入、加快静脉补液以维持循环,17:50手术结束,18:00患者血压及呼气末二氧化碳分压分别降至37/28 mmHg、8 mmHg,心率63 次/min,呼吸16次/min(呼吸机固定参数),动脉血气分析(FiO2=60%):pH值为7.57,PaO2 66 mmHg,PaCO2 16 mmHg,HCO3-14.7 mmol/L,立即停止输注自体血,调整去甲肾上腺素泵入剂量至0.5 μg·kg-1·min-1,给予阿托品0.5 mg维持循环,18:01患者皮肤发绀,脉搏氧饱和度降至77%,立即启动心肺脑复苏,并先后给予肾上腺素50 μg、肾上腺素30 μg静脉推注,18:04心电图提示室颤,立即给予电除颤,18:07患者血压、心率、脉搏氧饱和度和呼气末二氧化碳分压分别升至131/80 mmHg、143次/min、100%、33 mmHg,心电图提示恢复窦性心律,遂停止心肺复苏,继续去甲肾上腺素0.03 μg·kg-1·min-1泵入维持循环。术中出血600 ml,累计输注晶体2 700 ml、胶体1 000 ml、自体血280 ml。待患者生命体征平稳后急查血常规:血红蛋白114 g/L,血小板174×109/L;凝血功能:PT 23.9 s,APTT 64.7 s,TT 39.5 s,Fig 0.66 g/L,D-二聚体>76 mg/L FEU,凝血因子活性(表1);肌钙蛋白T 0.191 μg/L,NT-proBNP 388 ng/L。经食道超声心动图(床旁急诊超声,未采集图片)提示心包少量积液,二尖瓣及三尖瓣轻度反流。计算机断层扫描肺动脉造影(computed tomography pulmonary angiogram,CTPA)提示:右肺动脉主干及双肺动脉主要分支多发肺栓塞伴右室增大(图2)。床旁四肢静脉超声提示:未见明显血栓形成。后续查抗凝血酶Ⅲ、蛋白C、蛋白S、抗核抗体谱及抗中性粒细胞胞质抗体谱均无明显异常。
 图2 患者术后及随访CTPA结果,2A可见右肺动脉主干栓子(白色箭头);2B可见双侧肺动脉栓子(白色箭头);2C显示右心室和左心室的最大横径,分别为37.5 mm和30.9 mm,右心室与左心室最大横径的比值(RV/LV)为1.2(四腔心切面);2D,E可见肺动脉主干血栓消失,双侧肺动脉血栓减少(白色箭头);2F显示右心室和左心室的最大横径分别为28.4 mm和39.5 mm,RV/LV为0.7(四腔心切面);2G,H可见双肺动脉未见明显栓塞迹象;2I显示右心室和左心室的最大横径分别为32.9 mm和40.3 mm,RV/LV为0.8(四腔心切面)术后建议患者行经皮肺动脉介入取栓术,家属拒绝,反复告知相关风险后,家属仍要求保守治疗,请示呼吸内科会诊后建议使用低分子肝素抗凝,用量1/4~1/2支,无活动性出血后可逐步加至1支,1次/d,若抗凝期间再次出现血流动力学紊乱,需考虑挽救性介入取栓。与患方充分沟通抗凝治疗潜在的出血风险(如颅内血肿扩大、术区再出血、新发脑出血等)以及不进行抗凝治疗的血栓进展风险(如深静脉血栓形成、肺栓塞加重等)后,家属表示接受抗凝治疗并愿意承担相关风险。12月2日,患者术后意识水平为Ⅳ级,在纠正其凝血功能并评估头颅CT无活动性出血后于9:00给予依诺肝素20 mg,1次/d抗凝,16:27复查头颅CT未提示血肿扩大(图3A、B)。12月3日9:00,患者意识恢复至Ⅲ级,考虑到颅内无活动性出血,遂将依诺肝素剂量调至40 mg,1次/d,15:00患者意识加深至Ⅳ级,双瞳对光反射消失,颅内压波动于26~28 mmHg,15:28急查头颅CT(图3C)提示:右侧术区血肿扩大,中线移位明显,右脑室受压明显,立即停用依诺肝素,并行急诊手术清除血肿,术后患者意识恢复至Ⅲ级。12月6日,在评估患者凝血功能及头颅CT后重新启动依诺肝素20 mg,1次/d抗凝。12月8日,患者意识恢复至Ⅱ/Ⅲ级,调整依诺肝素用法为20 mg,1次/12 h,此后未发生出血事件。12月15日,患者意识恢复至Ⅰ/Ⅱ级,复查头颅CT(图3D)提示:颅内血肿基本吸收。12月21日,患者意识恢复至Ⅰ级,复查CTPA(图2D、E、F)提示:右肺动脉主干血栓消失,双肺肺动脉血栓较前明显减少,右心系统未见扩大。抗凝治疗期间,患者D-二聚体水平逐渐降低(图4),心肌标志物水平变化见图5。12月27日,患者好转出院,院外继续口服利伐沙班10 mg,2次/d抗凝3个月,服药期间未发生出血事件,3月30日复查CTPA提示双肺动脉未见明显栓塞迹象(图2G、H、I)。
图2 患者术后及随访CTPA结果,2A可见右肺动脉主干栓子(白色箭头);2B可见双侧肺动脉栓子(白色箭头);2C显示右心室和左心室的最大横径,分别为37.5 mm和30.9 mm,右心室与左心室最大横径的比值(RV/LV)为1.2(四腔心切面);2D,E可见肺动脉主干血栓消失,双侧肺动脉血栓减少(白色箭头);2F显示右心室和左心室的最大横径分别为28.4 mm和39.5 mm,RV/LV为0.7(四腔心切面);2G,H可见双肺动脉未见明显栓塞迹象;2I显示右心室和左心室的最大横径分别为32.9 mm和40.3 mm,RV/LV为0.8(四腔心切面)术后建议患者行经皮肺动脉介入取栓术,家属拒绝,反复告知相关风险后,家属仍要求保守治疗,请示呼吸内科会诊后建议使用低分子肝素抗凝,用量1/4~1/2支,无活动性出血后可逐步加至1支,1次/d,若抗凝期间再次出现血流动力学紊乱,需考虑挽救性介入取栓。与患方充分沟通抗凝治疗潜在的出血风险(如颅内血肿扩大、术区再出血、新发脑出血等)以及不进行抗凝治疗的血栓进展风险(如深静脉血栓形成、肺栓塞加重等)后,家属表示接受抗凝治疗并愿意承担相关风险。12月2日,患者术后意识水平为Ⅳ级,在纠正其凝血功能并评估头颅CT无活动性出血后于9:00给予依诺肝素20 mg,1次/d抗凝,16:27复查头颅CT未提示血肿扩大(图3A、B)。12月3日9:00,患者意识恢复至Ⅲ级,考虑到颅内无活动性出血,遂将依诺肝素剂量调至40 mg,1次/d,15:00患者意识加深至Ⅳ级,双瞳对光反射消失,颅内压波动于26~28 mmHg,15:28急查头颅CT(图3C)提示:右侧术区血肿扩大,中线移位明显,右脑室受压明显,立即停用依诺肝素,并行急诊手术清除血肿,术后患者意识恢复至Ⅲ级。12月6日,在评估患者凝血功能及头颅CT后重新启动依诺肝素20 mg,1次/d抗凝。12月8日,患者意识恢复至Ⅱ/Ⅲ级,调整依诺肝素用法为20 mg,1次/12 h,此后未发生出血事件。12月15日,患者意识恢复至Ⅰ/Ⅱ级,复查头颅CT(图3D)提示:颅内血肿基本吸收。12月21日,患者意识恢复至Ⅰ级,复查CTPA(图2D、E、F)提示:右肺动脉主干血栓消失,双肺肺动脉血栓较前明显减少,右心系统未见扩大。抗凝治疗期间,患者D-二聚体水平逐渐降低(图4),心肌标志物水平变化见图5。12月27日,患者好转出院,院外继续口服利伐沙班10 mg,2次/d抗凝3个月,服药期间未发生出血事件,3月30日复查CTPA提示双肺动脉未见明显栓塞迹象(图2G、H、I)。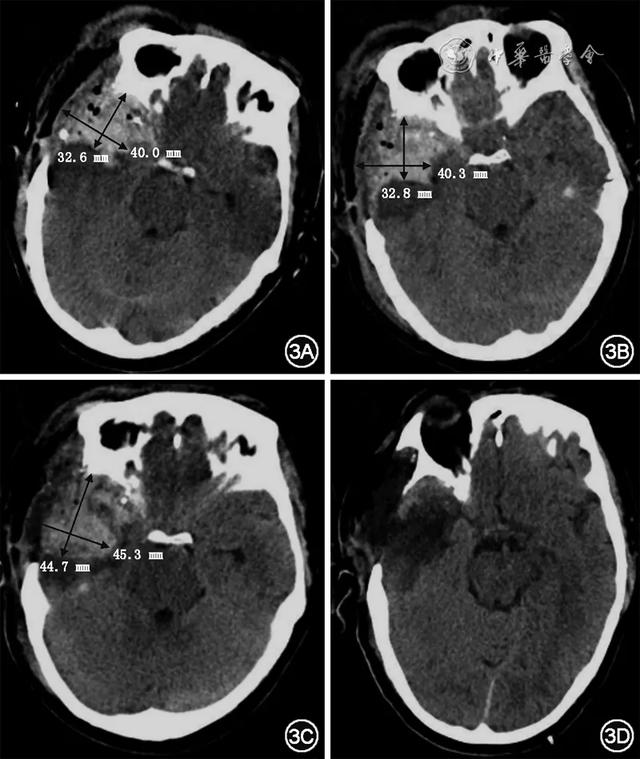 图3 患者头颅CT显示颅内血肿大小:3A为首次手术后12 h,范围32.6 mm×40.0 mm;3B为首次手术后22 h,给予依诺肝素20 mg,1次/d后7 h,血肿未见扩大,范围32.8 mm×40.3 mm;3C为首次手术后45 h,给予依诺肝素40 mg,1次/d后6 h,血肿明显扩大,范围44.7 mm×45.3 mm;3D为首次手术后14 d,给予依诺肝素20 mg,间隔12 h/次后7 d,血肿基本吸收
图3 患者头颅CT显示颅内血肿大小:3A为首次手术后12 h,范围32.6 mm×40.0 mm;3B为首次手术后22 h,给予依诺肝素20 mg,1次/d后7 h,血肿未见扩大,范围32.8 mm×40.3 mm;3C为首次手术后45 h,给予依诺肝素40 mg,1次/d后6 h,血肿明显扩大,范围44.7 mm×45.3 mm;3D为首次手术后14 d,给予依诺肝素20 mg,间隔12 h/次后7 d,血肿基本吸收 图4 患者D-二聚体水平随时间变化曲线
图4 患者D-二聚体水平随时间变化曲线 图5 患者心肌标志物水平随时间变化曲线
图5 患者心肌标志物水平随时间变化曲线讨论
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)患者的Caprini评分至少为5分[5],具有很高的静脉血栓栓塞风险。分析本例患者诊疗经过,存在以下特点:(1)术前及术后均无深静脉血栓形成的证据;(2)术中自体血回输过程中逐渐出现低血压及休克;(3)术后凝血功能及凝血因子活性存在显著异常,故我们推测该患者术中肺栓塞可能发生于自体输血期间,这或许与血液离体后未充分抗凝有关。目前常用于诊断肺栓塞的方法有3种,包括CTPA、肺通气/灌注扫描以及肺动脉造影。本例患者完善CTPA后肺栓塞诊断明确,由于同时伴有右心功能障碍及严重血流动力学紊乱,根据2019年ESC指南[4](表 2),可将该患者归为高危。由于CTPA对心脏的测量受多种因素影响,因此一般情况下使用心脏彩色多普勒超声诊断右心功能障碍,但由于患者在术中行床旁急诊心脏彩超,未能采集相关图片,故我们通过CTPA四腔心切面中右心室和左心室最大横径之比≥1作为右心功能障碍诊断依据。2019年ESC指南[4]表明,肺栓塞患者血流动力学紊乱需除外新发心律失常、低血容量或脓毒血症所致,由于本例患者休克发生于心室颤动之前,故考虑其休克并非新发恶性心律失常引起;结合心电图、心脏彩超、术中出血量、血常规等指标,其休克也非急性心肌梗死、心包填塞、低血容量所致;结合病史及实验室检查,也可排除脓毒血症所致休克可能。综上所述,该患者高危肺栓塞诊断基本明确。 系统性溶栓目前已成为高危肺栓塞的首选治疗策略,而出血性脑卒中(包括蛛网膜下腔出血)被认为是溶栓禁忌证。2016年美国胸科医师协会(American college of chest physician,ACCP)[6]认为,对于具有高出血风险的高危肺栓塞患者,可以考虑行导管介入治疗(2C),这与2019年ESC指南[4]的推荐意见相似。然而,若患者拒绝或医院无条件进行外科或介入治疗,高危肺栓塞的治疗就显得十分棘手。2016年ACCP指南[6]指出,如果肺栓塞患者低血压状态是暂时的或不明显的,且合并有出血高危因素,可以选择单纯抗凝治疗。但该建议仅基于经验判断,指南并未给出明确的证据级别。对于本病例中的患者而言,在心肺复苏并持续泵入血管活性药物后,没有再次出现血流动力学紊乱,因此抗凝治疗成为了他的最终选择。对于急性肺栓塞的抗凝治疗,依诺肝素的常规剂量为1 mg/kg q12h或1.5 mg/kg qd,但该剂量无法用于SAH患者[7]。遗憾的是,目前国内外尚无关于合并SAH的急性肺栓塞的抗凝治疗指南,仅能参考SAH后血栓化学预防相关指南[8, 9](表3)。2013年欧洲卒中组织(European stroke organization,ESO)[8]认为,动脉瘤性SAH患者可以在动脉瘤夹闭术12 h以后接受预防剂量低分子肝素。然而,2016年神经重症协会(neurocritical care society,NCS)[9]较ESO更为保守,认为化学预防只能在动脉瘤夹闭术24 h之后进行。本病例中的患者在动脉瘤夹闭术后15 h进行了首剂抗凝,治疗后未发生再出血。一项随机对照试验[10]表明,依诺肝素40 mg,1次/d不会显著增加动脉瘤性SAH患者血肿扩大的风险。但本例患者用药结果表明,依诺肝素20 mg,1次/12 h相较于40 mg,1次/d或许更安全,虽然2种给药方式的每日总剂量相同,但前者的血药峰浓度更高,可能会增加出血风险。
系统性溶栓目前已成为高危肺栓塞的首选治疗策略,而出血性脑卒中(包括蛛网膜下腔出血)被认为是溶栓禁忌证。2016年美国胸科医师协会(American college of chest physician,ACCP)[6]认为,对于具有高出血风险的高危肺栓塞患者,可以考虑行导管介入治疗(2C),这与2019年ESC指南[4]的推荐意见相似。然而,若患者拒绝或医院无条件进行外科或介入治疗,高危肺栓塞的治疗就显得十分棘手。2016年ACCP指南[6]指出,如果肺栓塞患者低血压状态是暂时的或不明显的,且合并有出血高危因素,可以选择单纯抗凝治疗。但该建议仅基于经验判断,指南并未给出明确的证据级别。对于本病例中的患者而言,在心肺复苏并持续泵入血管活性药物后,没有再次出现血流动力学紊乱,因此抗凝治疗成为了他的最终选择。对于急性肺栓塞的抗凝治疗,依诺肝素的常规剂量为1 mg/kg q12h或1.5 mg/kg qd,但该剂量无法用于SAH患者[7]。遗憾的是,目前国内外尚无关于合并SAH的急性肺栓塞的抗凝治疗指南,仅能参考SAH后血栓化学预防相关指南[8, 9](表3)。2013年欧洲卒中组织(European stroke organization,ESO)[8]认为,动脉瘤性SAH患者可以在动脉瘤夹闭术12 h以后接受预防剂量低分子肝素。然而,2016年神经重症协会(neurocritical care society,NCS)[9]较ESO更为保守,认为化学预防只能在动脉瘤夹闭术24 h之后进行。本病例中的患者在动脉瘤夹闭术后15 h进行了首剂抗凝,治疗后未发生再出血。一项随机对照试验[10]表明,依诺肝素40 mg,1次/d不会显著增加动脉瘤性SAH患者血肿扩大的风险。但本例患者用药结果表明,依诺肝素20 mg,1次/12 h相较于40 mg,1次/d或许更安全,虽然2种给药方式的每日总剂量相同,但前者的血药峰浓度更高,可能会增加出血风险。 2016年ACCP指南[6]认为由手术引起的肺栓塞需抗凝治疗3个月(1B),因此本病例中的患者出院后需继续抗凝。目前口服抗凝药主要包括华法林和直接口服抗凝药(direct oral anticoagulant,DOAC)。与华法林相比,DOAC(包括阿哌沙班、依度沙班、利伐沙班和达比加群)能够显著降低出血风险[11]。一般而言,利伐沙班治疗肺栓塞的常规用法为15 mg,2次/d治疗21 d后改为20 mg,1次/d,由于本病例中患者出血风险很高,故调整其剂量为10 mg,2次/d抗凝3个月,后续随访复查表明低剂量利伐沙班抗凝对该患者是安全有效的。综上所述,由于缺乏典型临床表现,术中肺栓塞的诊断十分困难,尤其是在无法使用CTPA的情况下。如果高危肺栓塞患者(低血压状态是暂时的或不明显的)合并溶栓禁忌,且无法进行手术或介入治疗,低剂量抗凝联合血管活性药物或许可以成为一种替代疗法,但需进一步的队列研究证实该方案的有效性及安全性。参考文献(略)
2016年ACCP指南[6]认为由手术引起的肺栓塞需抗凝治疗3个月(1B),因此本病例中的患者出院后需继续抗凝。目前口服抗凝药主要包括华法林和直接口服抗凝药(direct oral anticoagulant,DOAC)。与华法林相比,DOAC(包括阿哌沙班、依度沙班、利伐沙班和达比加群)能够显著降低出血风险[11]。一般而言,利伐沙班治疗肺栓塞的常规用法为15 mg,2次/d治疗21 d后改为20 mg,1次/d,由于本病例中患者出血风险很高,故调整其剂量为10 mg,2次/d抗凝3个月,后续随访复查表明低剂量利伐沙班抗凝对该患者是安全有效的。综上所述,由于缺乏典型临床表现,术中肺栓塞的诊断十分困难,尤其是在无法使用CTPA的情况下。如果高危肺栓塞患者(低血压状态是暂时的或不明显的)合并溶栓禁忌,且无法进行手术或介入治疗,低剂量抗凝联合血管活性药物或许可以成为一种替代疗法,但需进一步的队列研究证实该方案的有效性及安全性。参考文献(略) 