杨梅生物制药公司自研的一种HBV siRNA分子 AB-729,在2022年欧肝会上(EASL2022)带来多份新进展。在已公布的一项最新研究中,研究人员介绍了AB-729长期抑制表面抗原能力的有力证据,即在停用AB-729后可维持长期抑制效果,并在专门的乙肝e抗原阳性受试者队列中,也观察到类似的反应。

乙肝在研新药AB-729,在最后一剂后,HBsAg<100 IU/mL至少维持20周
AB-729,是一种 N-乙酰半乳糖胺 (GalNAc) 偶联的单触发RNA干扰乙肝候选药物,可靶向所有HBVRNA转录物,包括HBx,从而抑制乙肝病毒复制和所有病毒抗原。本届欧肝会上,研究人员报告了来自 AB-729-001 研究的更多治疗和随访数据,包括一个专门针对乙肝e抗原阳性受试者给药队列最新数据。
在 AB-729-001 研究的第3部分中,有 41 名非肝硬化的慢性乙肝受试者,接受每4周60毫克AB-729(Q4W,队列 E,N = 7),每8周60毫克(Q8W,队列 F,N = 7)、90毫克 Q8W(队列 I (N = 6)、G (N = 7) 和 K (N = 7)),或每12周90毫克(Q12W,队列 J,N = 7)。
G队列的受试者为 HBVDNA阳性,并在第1天开始使用富马酸替诺福韦二吡呋酯(TDF);其他所有队列,在稳定接受核苷(酸)类似物(NA)治疗中,均受到病毒学抑制。K队列在基线时,均为乙肝e抗原阳性。符合条件的受试者,可以继续使用 AB-729 至第 48 周。在 AB-729 停药后,对受试者进行 48 周或更长时间的随访。
40/41 名符合条件的受试者,在本研究中同意延长治疗。已报告了E队列和F队列的完整数据;在最后一次给药后的第32周和第36周,E队列和F队列的平均 HBsAg 变化分别为 -1.0 log10或更多,4/11 受试者的数据保持 <100 IU/mL。E队列中,有 1 名受试者在停用 AB-729后,仍服用核苷类时,发生了 HBsAg 血清学转换。
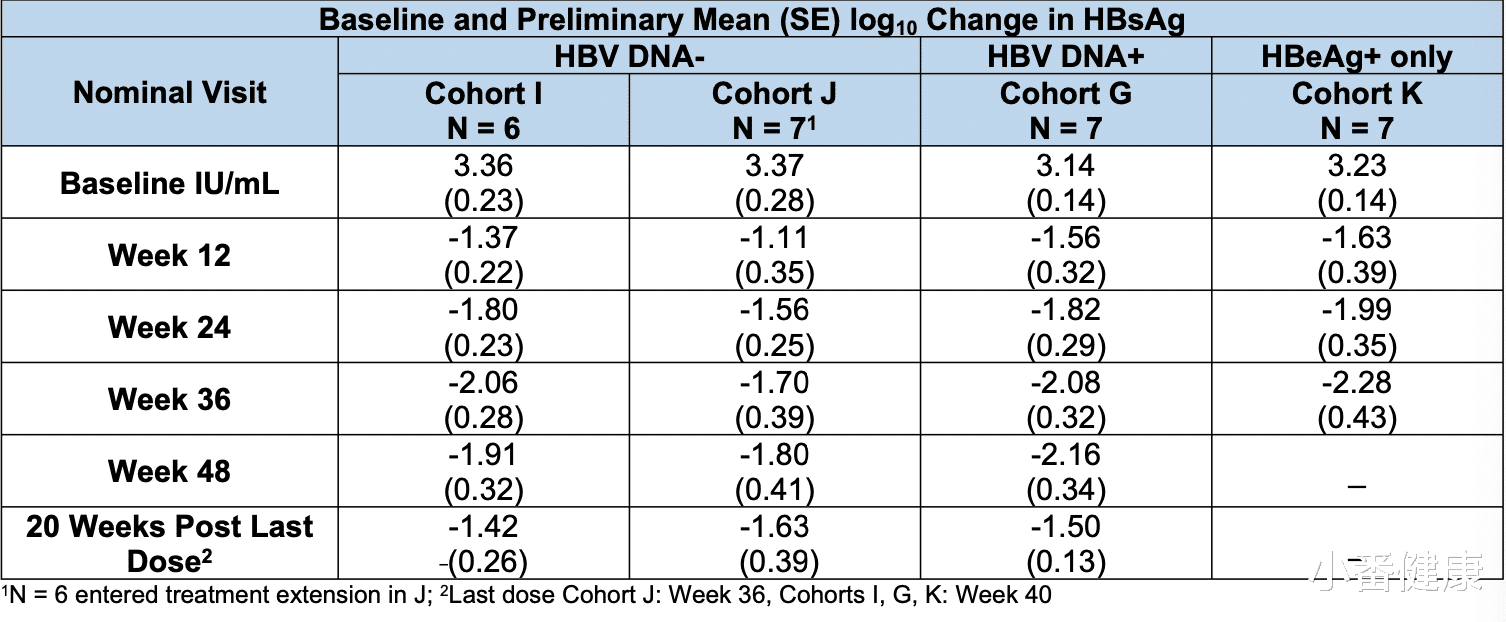
90毫克剂量下的 I队列、J队列、K队列和 G队列的平均 HBsAg 下降情况相似(可见上表)。在 I、J 和 G队列中,12/17 名受试者在第48周时数据 <100 IU/mL,有6名 <10 IU/mL。在最后一次给药后20周,有 11/18 名受试者的数据 <100 IU/mL,有 3名 <10 IU/mL。
在 K队列第32周时,HBeAg 的平均(SE) log10 变化为 -0.71 (0.44)。没有因 AE 导致的死亡或停药。有 2名不相关的 SAE;所有其他 AEs 均为 1级或2级。
综上所述,研究人员给出结论是:重复给药AB-729后,总体上仍然具有良好的安全性和耐受性,观察到乙肝表面抗原强劲且持续下降,在不同治疗方案中均具有可比性。
基线时的乙肝e抗原状态和DNA阳性,似乎都不会影响上述应答反应。在所有队列有数据的 17/31 名受试者中,乙肝表面抗原(HBsAg)< 100 IU/mL,在最后一剂注射AB-729后至少维持 20 周!这些数据支持继续评估AB-729作为慢乙肝联合方案的基石药物。

小番健康结语:这是另一份AB-729已发表在2022年欧肝会上比较积极的研究新进展。在本研究中,还专门提供了针对乙肝e抗原阳性受试者的队列,以评估AB-729不同剂量方案的安全性、耐受性及有效性。
核心结论大致可以归纳为:对受试者重复给予AB-729,依然表现出良好的安全性和耐受性,没有出现安全性信号,并在专门开辟的e抗原阳性队列中,也观察到相似的治疗反应,停用AB-729后,可以保持长期抑制,e抗原的状态与HBVDNA阳性,似乎都不会影响应答效果;
AB-729对乙肝表面抗原强劲而持久的调降作用,在以上不同方案中都是可以比较的。此外,在最后一次给予AB-729后,可以将 HBsAg <100 IU/mL,保持至少20周不变,这种抑制效果,即便在停用AB-729之后,也可以长期观察到,并在专门开辟的乙肝e抗原阳性队列中,也观察到相似反应。
