ALG-000184,它是ALG-001075的前药,是一种新型泛基因型II类CAM(空衣壳),具有皮摩尔效力,正被美国临床阶段生物制药公司(Aligos Therapeutics)开发用来针对慢性乙肝(CHB)治疗的1期临床试验。在AASLD大会上,研究人员带来了使用100毫克和300毫克剂量水平ALG-000184的1期试验最新数据。

乙肝在研新药ALG-000184,1期300毫克剂量,HBsAg下降高达0.78 log
Aligos研究人员认为,当前使用核苷(酸)类似物(NAs)的长期疗法,可以抑制CHB的HBV复制并减少肝脏损伤,但很少能达到功能性治愈,而这才是CHB治疗目标。因此,医学上对提高功能性治愈率的开创性新疗法有很大需求。
ALG-000184是一种研究阶段乙肝候选药物,它除了抑制pgRNA包被(主要作用机制MoA)外,在体外研究中,ALG-000184还被描述为通过调控cccDNA的重新建立和补充来抑制乙肝表面抗原(HBsAg)的产生(第二种MoA)。与抑制HBVDNA和RNA复制(EC50 1.98 nM)相比,在更高的浓度下(EC50 70.0 nM)观察到这种第二MoA机制。依据现有的1期数据,预计ALG-000184剂量≥100毫克时,就可以达到第二MoA所需的暴露量。
最新公布的研究,指ALG-000184-201研究,这是一项随机、双盲、多部分、安慰剂对照1期研究(临床试验编号:NCT04536337),在乙肝e抗原阳性CHB中评估多剂量的安全性、药代动力学(PK)和抗病毒活性。
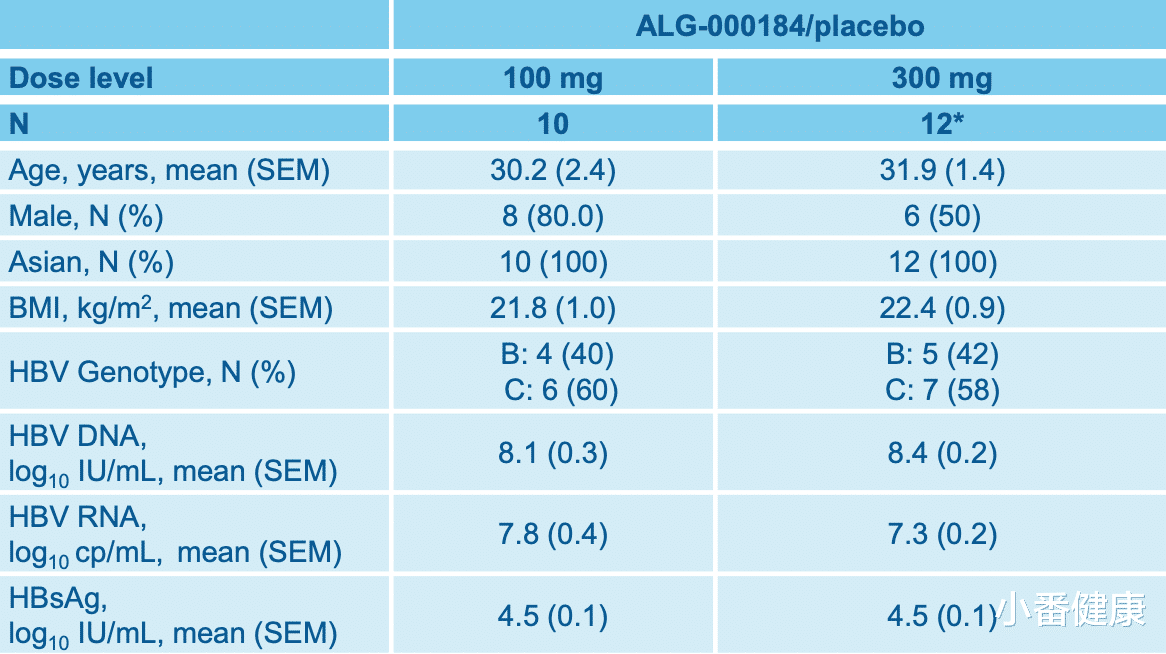
201研究的第1部分和第2部分,在健康受试者中评估了单次和多次口服剂量,且具有良好的剂量依赖性和线性PK耐受性。第2部分正在进行,评估多个队列 (N=10/队列;8个主动者:2个安慰剂[PBO]),目前未接受治疗的e抗原阴性或阳性受试者,每日(QD)口服ALG-000184,为期28天,之后随访8周。
截至目前为止,201研究结果表明,安全性方面:在100毫克与300毫克ALG-000184 QD x 28天,具有良好的耐受性。严重AE(SAE):在300毫克队列中,出现1名受试者在最后一剂给药后超过8周后因气胸住院,这被认为不太可能与研究药物有关。没有导致提前中止治疗的紧急AE(TEAE)。TEAEs的严重程度一般为轻度(1级)或中度(2级),无剂量反应。有6名受试者,出现ALT升高的≥3级TEAEs。没有关于实验室、心电图、生命体征或体检结果的临床报告。

抗病毒活性-对乙肝表面抗原影响方面:在7个可评估的受试者中,有3个使用300毫克ALG-000184,HBsAg水平的下降幅度为0.23至0.78 log10 IU/ml;在100毫克队列中,有1名高暴露量受试者(相当于300毫克ALG-001075),其HBsAg水平下降了0.5 log10 IU/ml。

抗病毒活性-对HBVDNA和HBVRNA影响方面:在乙肝e抗原阳性受试者中使用100毫克与300毫克的ALG-000184第28天时,HBVDNA/RNA的水平有类似的快速和大幅度下降。HBVDNA平均下降:4.2(100毫克),4.02 log IU/ml(300毫克)。HBVRNA平均下降:3.1(100毫克),2.6 log10 copies/mL(300毫克)。

药代动力学方面:血浆ALG-001075暴露量与ALG-000184剂量成比例增加,PK变异性低至中等。在28天内看到最小的积累(~30%)。

综上所述,研究人员得出结论:在乙肝e抗原阳性受试者中,每日口服100毫克与300毫克的ALG-000184,通常具有良好的耐受性,PK情况良好。在两个剂量水平上,都观察到类似的HBVDNA和RNA水平的快速而深刻的下降!观察到,在第28天内药物暴露剂量为300毫克的受试者中,HBsAg下降高达 0.78 log10 IU/mL,这表明该剂量/暴露水平可能与衣壳组装调节剂(CAM)的第二MoA有关。这一发现支持在更长时间内,评估ALG-000184以进一步表征其降低HBsAg水平的能力。
小番健康结语:这也是一项较为积极的乙肝新药临床开发进展,是有关1期试验评价100毫克、300毫克剂量水平的ALG-000184安全性、药代动力学和抗病毒活性新数据。以上研究进度,截至2022年11月末。
