导语
传统研究中,lncRNA被认为主要起到调控基因表达和细胞功能的非编码作用,但近年来的深入研究发现,部分lncRNA具有编码能力,可以转译出短的开放性阅读框(smORF)并编码功能性微肽(peptide)和蛋白质,进而调控生命活动,尤其是一些多肽在细胞信号传导、细胞周期调控和细胞凋亡方面发挥重要作用。
smORF和微肽
肽(peptide)是小分子的蛋白质,ncRNA可以编码蛋白质短肽(ncPeps);真核生物的蛋白质长度中位数为361aa,某些较短的氨基酸链被称为肽,在基因组中存在数十万上百万个小于100个密码子的短开放阅读框(smORF),smORF编码产生的多肽(SEP)来表示那些实际翻译的少于100个aa的蛋白产物。
SmORF包含多种类别,包括惰性DNA序列到转录和翻译的翻译顺式调控因子,然后产生功能性多肽,动物基因组中不同肽编码类别的smORFs有很大区别,可以代表基因、肽和蛋白质进化的步骤。

在小鼠中具有功能的smORF
某些ncRNA可以编码少于100个氨基酸的短肽,编码这些肽的序列被称为小开放阅读框(smORF),其中许多以传统的AUG起始密码子开始,但以非典型终止密码子结束;进而。ncPeps正逐渐成为一类新的功能分子,参与多种细胞活动过程,并在不同疾病的发病机制中表达失调。
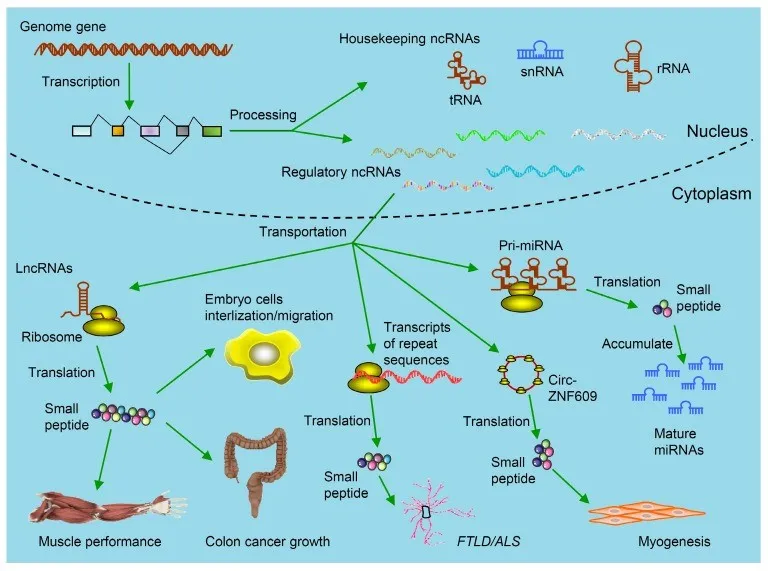
参与治疗诊断学的ncRNAs衍生小肽的种类
lncRNA编码微肽
上文中介绍过lncRNA可以调节基因的表达,会参与调节表观遗传;同时越来越多的研究发现一些lncRNA具有与编码基因相当的外源性特征,一些带有smORFs的lncRNA可以被翻译成肽。并且基于发育生物学的研究已经证明,一部分lncRNA可以与一个或多个核糖体结合,表明lncRNA可以翻译成肽或蛋白质;同时生物信息学分析显示,与典型的编码基因不同,lncRNA与核糖体的结合在不同物种中更为保守,并且多为低丰度表达,因此多起到一些调控作用。
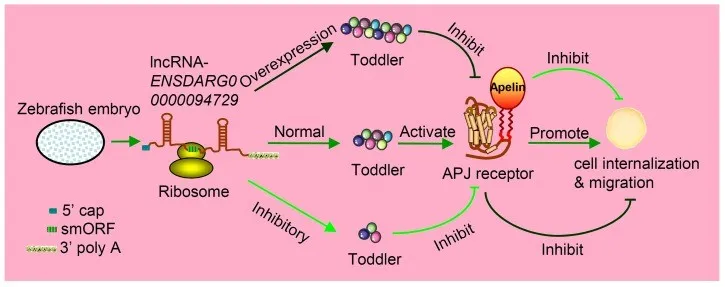
斑马鱼胚胎内细胞
迁移相关的lncRNA ENSDARG00000094729
含有 58-aa smORF,可编码产生肽Toddler
lncRNA编码微肽的预测
通过基于密码子比对的PhyloCSF和编码预测的CPS和sORF finder,以及编码区识别工具CRITICA和微肽检测管线micPDP计算得分。
lncRNA编码微肽的验证
通过生信分析鉴定到的短肽,需要借助实验手段验证其真实性。
(1)定量验证和翻译组
为了确定编码微肽的lncRNA是否活跃表达,需要用RT-PCR评估筛选出的编码微肽的lncRNA的表达情况(一般而言,表达微肽的lncRNA相对其他lncRNA会表达更活跃一些);同时从组织或细胞中分离纯化核糖体,进行RNC-RT-PCR(翻译组定量检测),评估目标lncRNA是否处在翻译状态中。

编码微肽的lncRNA和核糖体结合情况
(2)GFP验证编码多肽的真实性
为了验证编码微肽的smORF的活性,构建一系列载体:根据lncRNA上不同的ORF设计验证流程,在ORF后加上突变的GFP,只需要看那个ORF能带动后边的突变GFP正常表达,就可以知道具体LncRNA翻译的短肽了。
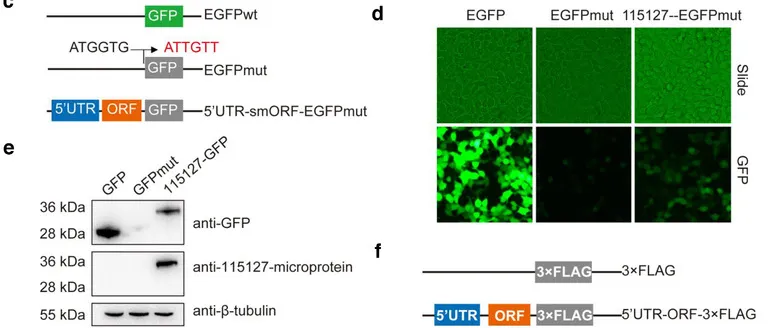
转染的GFP构建载体后的lncRNA微肽表达情况
(3)基于MS鉴定多肽
基于MS的蛋白质组学,直接检测组织中的分离出的蛋白(其中微肽的含量低),根据基于MS的微肽蛋白分析工作流程,工作流程是根据MS鉴定到的肽段进行搜库(跟常规蛋白组一样,但是需要借助微肽数据库),常用的微肽数据库有:Myoregulin、Myomixer、Minion、HOXB-AS3和SPAR 、NoBody、LINC-PINT等数据库。

基于MS发现有lncRNA编码的微肽的工作流程
ncPeps数据库
ncPeps相关的数据库资源,有cncRNAdb、FuncPEP、LncPep、ncEP、PepTransDB、SmProt、sORFs.org、SPENCER和TransLnc、CodLncScape等这些数据库可以为研究者提供详尽的ncPeps和相关ncRNAs的全面信息,研究者可以借助上述数据库探索ncPeps在细胞生物过程和疾病中的功能,以及挖掘特征性ncPeps的潜在应用价值。后续推文会重点介绍上述微肽相关的数据库。
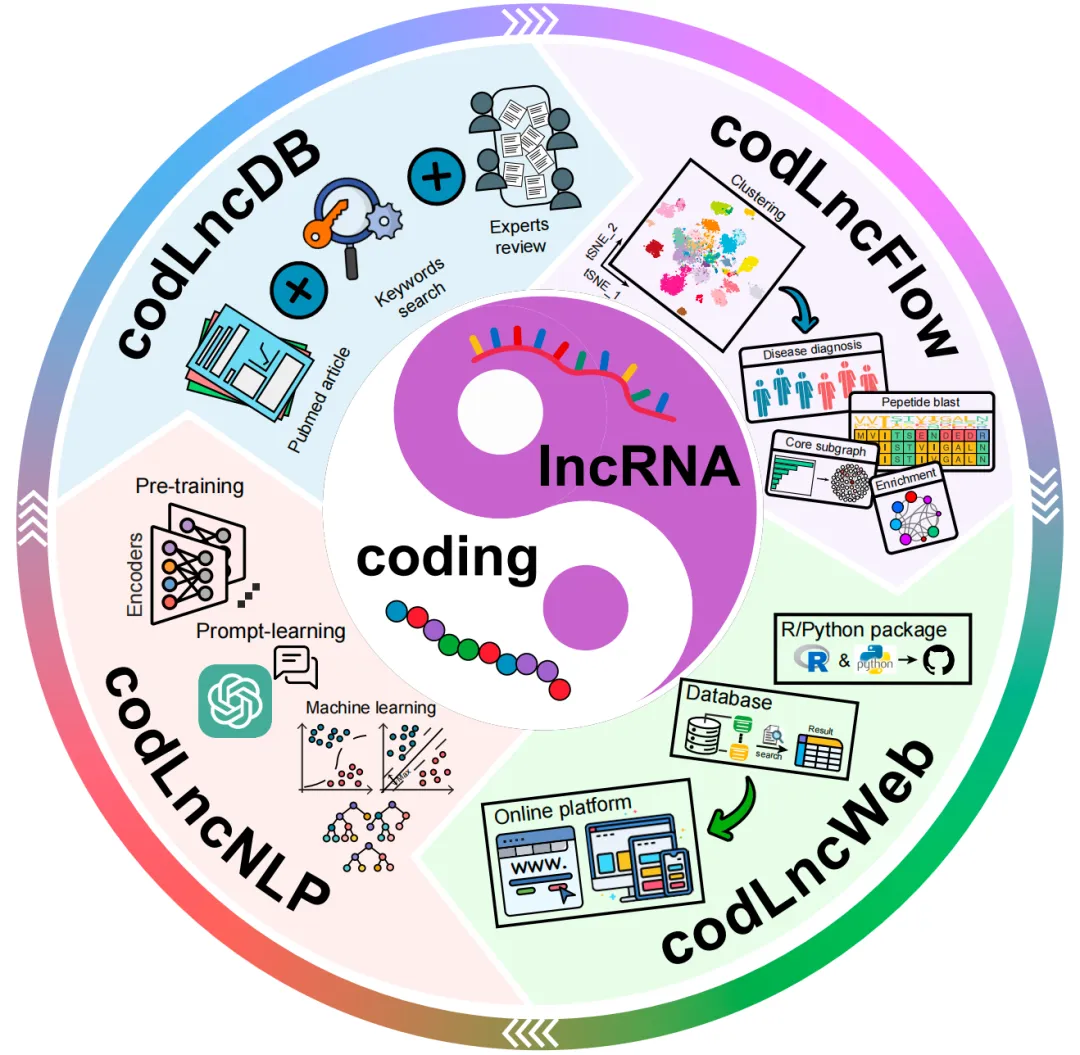
CodLncScape数据库框架
LncRNA编码多肽研究案例
LncRNA翻译成短肽的故事,第一步是要验证短肽存在的真实性,根据lncRNA上不同的ORF设计验证流程,在ORF后加上突变的GFP;这个GFP把起始翻译的ATG替换成了ATT,于是只需要看那个ORF能带动后边的突变GFP正常表达,就可以知道具体LncRNA翻译的短肽了。

第二步,在找到lncRNA翻译出的短肽后,就需要验证这个短肽可能的功能,使用柯霍氏法则进行验证,验证结果发现:高表达短肽可以促进肿瘤的恶性表型。
第三步,需要构建编码短肽的目标lncRNA的上下游调控路径,文中找到了lncRNA的m6A甲基化修饰,并证实了和短肽相互作用的蛋白NIPSNAP1。
第四步,区分lncRNA调控和lncRNA表达短肽的调控的区分,细胞系中分别表达LncRNA和短肽的细胞系,结果发现短肽高表达的细胞,肿瘤的上皮细胞恶性转化更高:

研究结果揭示了lncRNA AFAP1-AS1在调节细胞过程中的作用,lncRNA AFAP1-AS1编码线粒体定位肽ATMLP,通过促进线粒体自噬来增加肿瘤细胞的活力;lncRNA AFAP1-AS1上的ORF起始区域的m6A甲基化可以吸附核糖体,进而编码短肽,上述短肽可以充当致癌基因促进肿瘤细胞的活力。

参考文献
Saghatelian、Alan 和 Juan Pablo Couso。“smORF编码的生物活性多肽的发现和表征。”自然化学生物学第11,12卷(2015):909-16。doi:10.1038/nchembio.1964
库索、胡安-巴勃罗和佩德罗·帕特拉金。“小型开放式阅读框架的分类和功能。”自然评论。分子细胞生物学第18卷,第9期(2017):575-589。doi:10.1038/nrm.2017.58
Pang, Yanan et al. “非编码RNA的编码活动”。治疗诊断学,第8卷,第9期,2496-2507。2018年3月28日, doi:10.7150/thno.24677
Cai, Tanxi et al. “LncRNA 编码的微蛋白:细胞培养衍生和循环细胞外囊泡中的一种新形式的货物。”细胞外囊泡杂志第 10,9 卷 (2021):e12123。doi:10.1002/jev2.12123
Liu T.Y., Qiao H.Y., and Wang Z.X. et al. CodLncScape 为编码 LncRNA 的系统收集和探索提供了一个自富集框架。高级科学 (2024)。
Pei, Hailong, et al. “lncRNA AFAP1-AS1 的致瘤作用是由翻译肽 ATMLP 介导的,在 m6A 甲基化的控制下。”高级科学 10.13 (2023):2300314。
