
癌症,目前最主流的观点是认为其起源于我们人体内体细胞基因突变的积累。当我们体内的一个正常细胞「堕落」成为癌细胞后,它会开始大肆破坏我们的人体:

相信大家能够直观的感受到,身边患癌的人群越来越多了。事实上也确实如此,近期,国家癌症中心基于全国肿瘤登记及随访监测最新数据,在全球顶尖期刊《JNCC》上发布了2022年中国恶性肿瘤疾病负担情况:2022年,我国癌症新发病例约为482.47万例,每10万人中341.75人患上癌症。癌症正在成为我们面临的世纪健康难题。
面对癌症的挑战,医学界也在不断进行着诊疗理念和策略的迭代。在过去,癌症的治疗通常以化疗为主,它是杀伤癌细胞高效的治疗手段。但化疗最大的问题是在打仗时容易误伤「群众」,化疗针对的是癌细胞快速增殖的特性,处在生长周期的正常细胞也会进入它的“瞄准镜”。人体骨髓造血组织、胃肠道黏膜、生殖细胞、神经元等正常细胞都可能遭到误伤,正所谓「杀敌一千,自损八百」。

随着我们对癌细胞的不断了解,以及我们治疗手段的进步,「精准治疗」的理念诞生了。精准治疗的核心,在于针对癌细胞本身分子生物学的改变,选择特定的药物进行治疗。通俗来理解就是我们常说的「靶向治疗」。靶向治疗可以根据癌细胞的特点,锁定并消灭癌细胞,大幅降低正常组织遭到误伤的可能性。

但是,面对肿瘤细胞的异质性,靶向治疗也有其局限:无法对所有癌细胞一网打尽。化疗药物和靶向药物的单兵作战能力都很强,但都有其各自的局限性。我们能否研发出一种药物,即有化疗的高效的抗癌效果,又兼具靶向治疗精准且低毒的优势呢?
——靶向与化疗结合,改单兵作战为团队协作,就能实现这个目标。抗体偶联药物(ADC)自此诞生,在癌症治疗领域刮起一场「ADC风暴」,成为继免疫治疗之后又一类重要的抗癌药物。尤其以德曲妥珠单抗(T-DXd)、Dato-DXd、HER3-DXd等一系列药物具备巨大的抗癌潜力,涵盖了HER2、Trop-2、HER3等一系列癌症相关重要靶点。

ADC药物的概念,最早来自100多年前诺奖得主Paul Ehrlich(保罗·埃尔利希)提出的“魔法子弹”理论,这个称呼一直沿用至今。它到底有何魔力?它又是如何实现化疗与靶向的团队协作?我们首先从它的结构说起。

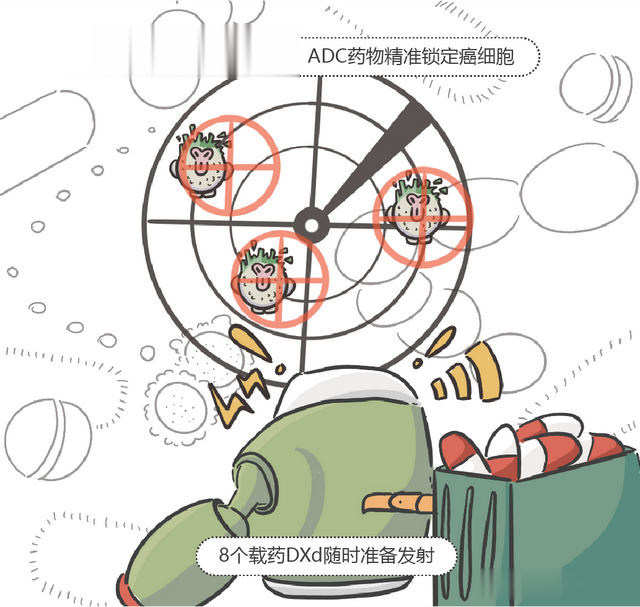
ADC类药物由3个部分组成,分别是单克隆抗体(Antibody)、连接子(Conjugate)以及荷载的毒素小分子(Drug)。其中:
单克隆抗体:负责对癌细胞的「精准识别」,即ADC药物的「导航系统」,同时它还可以协同调动人体免疫系统杀伤肿瘤细胞;连接子:负责连接单克隆抗体与细胞毒药物,同时可以保持ADC药物稳定,确保细胞毒药物精准释放至肿瘤组织内部;毒素小分子:通过单克隆抗体与连接子的协同,具备强杀伤效果的细胞毒药物可以精准抵达癌细胞内部,杀伤癌细胞。
这样的A+D+C的结构,组成了ADC药物。治疗过程中,三个部分通力协作,ADC药物可以实现精准、高效、低毒的抗癌机制。以T-DXd为例:


ADC药物的具备的「三重灭癌机制」,也是实现其高效抗癌效果的重要保障:
A:直接消灭癌细胞

B:旁观者效应:基于DXd小分子毒素具有的膜通透性,在完成靶标癌细胞的消灭后,还可以进入周边的肿瘤细胞进行杀伤,并破坏肿瘤内的基质细胞和肿瘤血管,扩大抗癌战果。

C:抗体免疫介导效应(ADCC、ADCP):在ADC药物识别癌细胞并与癌细胞表面标志物结合后,ADC的抗体部分可调动人体免疫系统,招募多种免疫细胞对癌细胞进行杀伤。

如此精妙的团队配合,自然带来了以T-DXd为代表的ADC药物的成功。目前,T-DXd是肺癌领域首个且目前唯一获批的ADC药物。不仅如此,这些进步还代表了更加深远的希望。

抗体偶联药物的研发,最核心的就在于这类药物的技术平台。换一个不同的靶点的抗体(弹头),就会诞生出针对其它靶点、其他癌症类型的新药。T-DXd的成功,能够为抗癌治疗带来无限的想象力。例如与T-DXd相同技术平台的ADC药物HER3-DXd和Dato-DXd也有了非常不错的临床数据,未来有望给肺癌患者带来全新选择。
