本文来源:中华儿科杂志, 2024,62(10) : 909-919.
急性髓系白血病(acute myeloid leukemia,AML)是一组以髓系细胞分化受阻、幼稚细胞克隆增殖为特征的血液系统恶性肿瘤。儿童AML占儿童急性白血病的15%~20%,但儿童AML的生存率仅为60%~70%,改善儿童AML的预后成为儿童急性白血病治疗中亟待解决的临床现实难题。近年来,国际上在AML的诊断、分类、危险度分层、靶向治疗及其联合治疗、微小残留病(minimal residual disease,MRD)监测等方面的研究取得了很多进展,并对相关诊疗指南进行了更新。我国自2006年后未再制定或更新儿童AML的诊疗指南。由于生物学特点、临床特点及远期预后的差异,儿童AML并不能完全采用成人AML的诊治指南。为了促进临床医师对于儿童AML的认识和理解,指导和规范临床实践,中国医师协会儿科医师分会儿童血液肿瘤学组、中华医学会儿科学分会血液学组、中华医学会儿科学分会肿瘤学组组织国内相关专家制定了本专家共识,本共识中的AML不包含急性早幼粒细胞白血病。
一、AML的诊断及分类
(一)AML的诊断
儿童AML的诊断参照第5版(2022)世界卫生组织(World Health Organization,WHO)造血与淋巴组织肿瘤分类标准(简称2022 WHO分类标准)及2022版欧洲白血病网(European Leukemia Net,ELN)成人AML诊断和管理建议(简称2022 ELN建议),所有疑诊病例需经形态学-免疫学-细胞遗传学-分子生物学(morphology-immunology-cytogenetics-molecular biology,MICM)明确诊断与分型,并需符合以下标准中的一项:(1)骨髓中髓系原始细胞+幼稚细胞比例≥0.20;(2)特定性遗传学异常,如伴RUNX1::RUNX1T1、CBFB::MYH11等融合基因,伴KMT2A、NUP98等基因重排(除外AML伴CEBPA基因突变、BCR::ABL1融合基因),即使骨髓中髓系原始细胞+幼稚细胞比例<0.20,亦可诊断。经PCR和(或)荧光原位杂交法(multiplex fluorescence in situ hybridization,FISH)证实存在融合基因或基因重排,或经染色体核型分析证实存在融合基因、基因重排对应的染色体易位。(3)髓系肉瘤:是AML的一种特殊类型,为髓系原始细胞组成的髓外肿块,对不伴骨髓或外周血白血病细胞浸润的髓系肉瘤,需有病理诊断依据。
本共识提出AML的诊断需在综合临床与病理的基础原则之上,强调遗传学特征在诊断分型时的优先重要性。
(二)AML的分类
本共识综合了2022 WHO分类标准及2022 ELN建议,采用“特定性遗传学异常”替代既往“重现性遗传学异常”的表述。包括基于特定性遗传学异常的AML和基于分化定义的AML两种分类(表1)。

二、危险度分层
近年来随着各种组学及测序技术的广泛应用,对儿童AML危险度分层的认识也在逐年丰富及更新。本共识综合患儿初诊时细胞遗传学、分子遗传学改变以及对治疗的反应进行危险度分层,低危组需满足细胞遗传学、分子遗传学其中之一,伴NPM1基因突变或核心结合因子(core binding factor,CBF)AML需满足多参数流式细胞术(multiparametric flow cytometry,MFC)MRD、分子MRD其中之一即可,具体危险度分层见表2。

三、初治AML的诊疗方案
儿童AML的治疗目标是控制并尽可能根治疾病。本共识基于精准MICM特征进行危险度分层治疗,并建议标准治疗基础上联合靶向治疗、免疫治疗的减低化疗强度的个体化治疗,以减少近期及远期不良反应。
(一)诱导治疗前减积治疗
外周血白细胞计数>50×109/L的患儿应行减积治疗,治疗目标为外周血白细胞计数降至<25×109/L,可选以下一种或几种药物:
1.羟基脲:10~40 mg/(kg·d),分2~3次/d(使用不超过2周)。
2.阿糖胞苷:40~100 mg/(m2·次),1次/d或每12小时1次(不超过7 d)。
3.高三尖杉酯碱(homoharringtonine,HHT):1 mg/(m2·d)(不超过5 d)。
4.维奈克拉:25~50 mg/(m2·d)(可联合羟基脲或阿糖胞苷或HHT)。
5.高危组:可酌情加用蒽环类药物。
(二)诱导治疗
对于AML患儿的诱导治疗,推荐在以阿糖胞苷为主的骨架治疗方案基础之上,可联用其他细胞毒药物或靶向药物治疗,推荐进行1~2轮诱导治疗。
1.骨架治疗方案:DA方案(柔红霉素+阿糖胞苷)、HA方案(HHT+阿糖胞苷)、IA方案(去甲氧柔红霉素+阿糖胞苷):柔红霉素40 mg/(m2·d)或去甲氧柔红霉素10 mg/(m2·d),第1、3、5天或第1~3天;HHT 3 mg/(m2·d),第1~5天;阿糖胞苷100 mg/(m2·次),间隔12 h 1次,第1~7天。
2.DAH方案(DA方案+HHT)、DAE方案(DA方案+依托泊苷)、IAH(IA方案+HHT)、IAE(IA方案+依托泊苷):DA、HA、IA、HHT剂量同骨架治疗方案,依托泊苷推荐剂量为100 mg/(m2·d),第1~5天。
3.VAH方案(维奈克拉+HA方案):维奈克拉推荐剂量为50 mg/(m2·d),第1天;100 mg/(m2·d),第2天;200 mg/(m2·d)(最大400 mg/d),第3~14天(耐受好可延长至28 d)。
4.低剂量方案:如低剂量HAG[HHT+阿糖胞苷+粒细胞刺激因子(granulocyte colony-stimulating factor,G-CSF)]、低剂量MAG(米托蒽醌+阿糖胞苷+G-CSF)、低剂量idAG(去甲氧柔红霉素+阿糖胞苷+G-CSF)、低剂量VAH(维奈克拉+阿糖胞苷+HHT)、低剂量VAH+去甲基化药物(如阿扎胞苷、地西他滨)方案:维奈克拉剂量同VAH方案,其中HHT 1 mg/(m2·d),第1~5天;米托蒽醌或去甲氧柔红霉素 5 mg/(m2·d),第1、3、5天;阿糖胞苷10 mg/(m2·次),间隔12 h 1次,第1~10天;阿扎胞苷75 mg/(m2·d),第1~7天或地西他滨20 mg/(m2·d),第1~5天;G-CSF推荐剂量:3~5 μg/(kg·d),第1~10天(若外周血白细胞计数>5.0×109/L,可暂不用G-CSF)。
根据患儿对化疗药物的耐受程度及分子生物学特征,可酌情选择加用靶向药物及低剂量的诱导治疗方案。
(三)巩固治疗
1.诱导治疗后获完全缓解的低、中危组患儿或不行造血干细胞移植的高危组患儿,推荐大剂量阿糖胞苷为基础[1~3 g/(m2·次)]的巩固治疗3~4个疗程,有治疗靶点的患儿可酌情加用靶向治疗。(1)MA方案(米托蒽醌或米托蒽醌脂质体+阿糖胞苷):米托蒽醌 10 mg/(m2·d),共2~3 d或米托蒽醌脂质体 20 mg/m2,分1~2 d给药;阿糖胞苷1~2 g/(m2·次),间隔12 h 1次,第1~3天。(2)HAL方案:HHT剂量同骨架治疗,阿糖胞苷1~2 g/(m2·次),间隔12 h 1次,第1~3天。(3)CLASP方案(阿糖胞苷+门冬酰胺酶):阿糖胞苷3 g/(m2·次),间隔12 h 1次,低危组共2 d(4剂),中、高危组共3 d(6剂);左旋门冬酰胺酶6 000 U/m2或欧文菌门冬酰胺酶10 000 U/m2或培门冬酰胺酶2 000 U/m2(在最后1剂阿糖胞苷后给予)。(4)EA方案(依托泊苷+阿糖胞苷):依托泊苷 100~150 mg/(m2·d),共2~3 d;阿糖胞苷3 g/(m2·次),间隔12 h 1次,共2~3 d(4~6剂)。
2.不行造血干细胞移植的高危组患儿推荐再予1个疗程阿糖胞苷为基础的化疗方案。
(四)维持治疗
目前AML患儿的维持治疗仍存在争议,儿童AML可用如下方案进行维持治疗。
1.维甲酸+巯嘌呤维持方案:维甲酸 20~30 mg/(m2·d)口服2周、巯嘌呤 50 mg/(m2·d)口服10周交替为1个循环,共4个循环,维持48周。
2.单用维奈克拉 200 mg/(m2·d)口服2周、停2周,维持48周;或维奈克拉口服2周、停6周基础上叠加维甲酸 20~30 mg/(m2·d)口服1周、停1周,黄黛片 50~60 mg/(kg·d)口服2周、停2周,维持48周。
3.阿扎胞苷为基础的维持方案:75 mg/(m2·d)应用1周、停3周,建议维持48周,可酌情叠加维奈克拉。
4.对有明确治疗靶点的患儿可予小剂量靶向药物(如吉瑞替尼)维持治疗1年,本共识推荐用法:在原有维持治疗方案的基础上,每8周加用吉瑞替尼,2 mg/(kg·d)×28 d,最大量120 mg/d 。
(五)中枢神经系统白血病的预防及治疗
儿童AML应在全身化疗的同时进行鞘内注射预防或治疗中枢神经系统白血病,见表3。
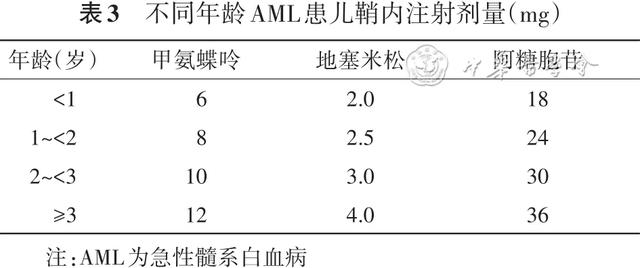
1.第1疗程:除法、美、英分型系统(French-American-British,FAB)分型为M4、M5患儿,其他患儿可根据病情决定第1疗程是否予脑脊液检查及鞘内注射。当外周血白细胞计数>100×109/L或外周血存在幼稚细胞时需暂缓鞘内注射。对存在神经系统症状、除外颅内出血及占位,且脑脊液存在明确白血病细胞的患儿,在首次鞘内注射后,每周进行2次鞘内注射,直到脑脊液恢复正常。
2.第2疗程及以后:每疗程鞘内注射1次,总鞘内注射4~6次。
四、MRD
AML整个强化疗过程中,MRD 与不良预后之间的关系在多个时间点都得到了证实,且无论采用哪种MRD检测方法,虽敏感度和特异度不同,但MRD阳性都与不良预后相关。
(一)MFC-MRD
MFC检测MRD的方法是目前最常用的方法。
1.MFC-MRD样本要求:(1)骨髓或外周血样本:建议采用第1次抽吸的骨髓进行MFC-MRD分析,室温下储存的样本需在3 d内进行分析,骨髓样本采集2~5 ml即可,初诊时若因特殊情况无法获得骨髓,外周血幼稚细胞比例>0.20时也可用于诊断,但需采集10~20 ml样本,取决于单核细胞数量,要求单核细胞数至少达到5×106。后续MRD监测尤其是缓解后,不推荐用外周血样本。(2)脑脊液样本:至少需2 ml脑脊液,建议在1 h内送检,最多不超过4 h。
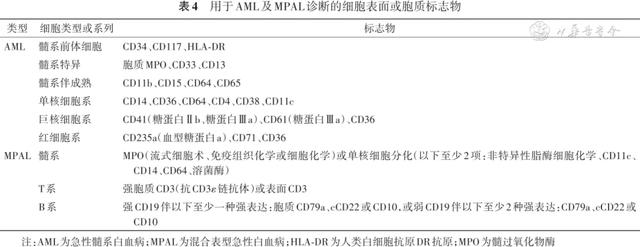
2.MFC-MRD检测抗体推荐:本共识建议统一使用综合“白血病相关免疫表型”和“不同于正常细胞表型”的策略进行MRD检测,需包括AML“骨架”抗体:即CD34、CD117、CD45、CD33、CD13、CD56、CD7、HLA-DR,见表4。
3.MFC-MRD检测时间及危险度调整:每轮诱导治疗第28天、巩固治疗后第28天(或下一疗程治疗前)。维持治疗期每4~6个月检测1次,停药时检测1次。根据诱导治疗后MRD水平进行以下危险度分组的调整(图1)。

注:MRD为微小残留病;对于治疗前评估为低危或中危的伴NPM1基因突变或核心结合因子相关急性髓系白血病,第1疗程诱导治疗后若MRD≥1.0%,可暂不升级为高危,2轮诱导治疗后MRD≥0.1%者则均需升级为高危
▲图1 根据诱导治疗后MRD水平调整危险度分级流程
(二)分子MRD检测
PCR方法包括经典实时定量PCR和数字PCR。PCR仅限于具有以下遗传学异常的AML患儿,包括NPM1基因突变、RUNX1::RUNX1T1融合基因、CBFB::MYH11融合基因、KMT2A基因重排、BCR::ABL融合基因。另外,不同类型的白血病从分子水平复发到血液学复发所需的时间不尽相同,建议根据疾病的不同类型和遗传学特征制定个体化的检测频率。
值得注意的是,对于CBF-AML及NPM1基因突变AML来说,常可在已获得完全缓解时仍持续检测到其分子MRD低水平(MRD at low-level,MRD-LL),因此对于流式MRD阴性,分子MRD于检测阈值(2%)以下的患儿,可称之为完全缓解伴MRD-LL(MRD-LL复发的定义见“AML治疗反应的标准”部分)。多项研究表明持续稳定的完全缓解伴MRD-LL并无提示复发的意义,但部分研究认为造血干细胞移植前分子MRD持续存在是造血干细胞移植后预后不良的独立危险因素,如果其可耐受强化疗,可考虑造血干细胞移植前采用清髓预处理方案或造血干细胞移植后尽早的免疫抑制治疗。
(三)二代测序(next generation sequence,NGS)-MRD
对于基于NGS的MRD,不同时间点、组织和靶基因的预后和预测相关性都在研究中。生物信息学方法还需要标准化及建立质控标准。监测单个患者的多个基因突变时,NGS-MRD若能检测到单个、几个或所有基因,其结果将如何解释、是否存在预后差异这些问题仍需要进一步研究。另外NGS-MRD方法的优点和局限性仍需进一步明确。就目前的方法而言,MFC-MRD与NGS-MRD结果并不完全一致,有时互为补充,因此需要相互结合判断。
五、AML治疗反应的标准
临床试验中作为评价结局的指标不同,其临床结局往往不同,这对于指导临床试验设计和分析都具有重要意义。因此本共识对AML治疗反应的标准总结如下。
1.完全缓解:骨髓髓系原始细胞比例<0.05,外周血无幼稚细胞或幼稚细胞无奥氏小体;无髓外病变;中性粒细胞计数(absolute neutrophil count,ANC)≥1.0×109/L且血小板计数≥100×109/L。
2. 完全缓解伴部分血液学恢复(complete remission with partial hematologic recovery,CRh):ANC≥0.5×109/L且血小板计数≥50×109/L,符合其他完全缓解标准。
3. 完全缓解伴不完全血液学恢复(complete remission with incomplete hematologic recovery,CRi):ANC<1.0×109/L或血小板计数<100×109/L,符合其他完全缓解标准。若同时用CRh、CRi,则CRi应仅包括不符合CRh的其他患儿。
4.部分缓解:符合完全缓解所有血液学指标;骨髓幼稚细胞比例较初诊下降至少50%且下降至0.05~0.20。
5.形态学无白血病状态(morphologic leukemia free state,MLFS):骨髓髓系原始细胞比例<0.05;幼稚细胞无奥氏小体;外周血无幼稚细胞;无髓外病变;无需血液学恢复。MLFS主要用于Ⅰ、Ⅱ期临床试验。
6.无反应:患儿处于可评估状态,在设定的反应评估节点前(如2个疗程强化疗诱导方案治疗后、减低强度化疗180 d后),不符合完全缓解、CRh、CRi、MLFS或部分缓解标准的,即视为无反应。
7.完全缓解、CRh或CRi不伴MRD:实时定量PCR、MFC或NGS检测,MRD低于定义阈值的完全缓解、CRh或CRi。
8.难治性AML:在设定的反应评估节点前未获得完全缓解、CRh或CRi。
9.复发性AML:完全缓解、CRh或CRi后骨髓髓系原始细胞比例≥0.05(除外巩固化疗后骨髓再生等其他原因)或外周血再次出现白血病细胞(至少间隔1周的2次外周血检查);髓外出现白血病细胞浸润。
10.MRD复发:(1)任何检测方法下,MRD阴性患儿的MRD转阳即视为MRD复发(需经第2次骨髓检测复核);(2)对完全缓解伴MRD-LL、CRh伴MRD-LL或CRi伴MRD-LL患儿,实时定量PCR方法检测的2次(间隔至少2周)MRD拷贝数增加≥1个log,即视为MRD复发。
六、复发、难治性AML 的治疗
对复发AML选择再诱导方案时应综合考虑复发时间、对诱导治疗的初始反应、蒽环类药物的累积剂量、化疗药物的可用性以及是否存在可能适合靶向治疗的特定基因突变。建议对复发患儿重新进行高通量测序检查(如RNA测序等),在患儿监护人充分知情同意情况下,可选用新型靶向、免疫治疗方案联合或不联合常规化疗,也可采用嵌合抗原受体T细胞治疗,也可考虑临床试验,获得MRD转阴后尽快行造血干细胞移植,为此可选用以下推荐治疗方案一种或几种:
1. FLAG(氟达拉滨+阿糖胞苷+G-CSF)方案:氟达拉滨25~30 mg/(m2·d),第1~5天;阿糖胞苷 2 g/(m2·d),第1~5天;G-CSF 3~5 μg/(kg·d)(最大量300 μg),第0天开始,共5~7 d。对既往蒽环类药物未达最大累积剂量300 mg/m2的患儿或早期复发患儿,可考虑在FLAG基础上添加蒽环类药物。
2.CLAG(克拉屈滨+阿糖胞苷+G-CSF)方案:克拉屈滨9 mg/(m2·d),最大量 10 mg/d,第1~5天,共 5 次;阿糖胞苷 1 g/(m2·d),第1~5天(与克拉屈滨间隔2 h);G-CSF剂量同FLAG方案。
3.CHAG方案(阿克拉霉素+HHT+阿糖胞苷+G-CSF):阿克拉霉素 6 mg/(m2·d),第1~8天;HHT 1 mg/(m2·d),第1~7天;阿糖胞苷10 mg/(m2·次),间隔12 h 1次,第1~14天;G-CSF 3~5 μg/(kg·d),最大量300 μg/d,第1~14天,外周血白细胞计数≥20×109/L停用。
4.吉妥珠单抗(gemtuzumab ozogamicin,GO)为基础的方案:GO 3 mg/(m2·d),第4、7、10天,联用去甲基化药物[地西他滨 20 mg/(m2·d),第1~5天,或阿扎胞苷 75 mg/(m2·d),第1~7天,可适当减少至3 d]和化疗药物[阿克拉霉素10 mg/(m2·d),第3~6天;阿糖胞苷10 mg/(m2·次),间隔12 h 1次,第2~9天;G-CSF 3~5 μg/(kg·d),第2~9天]。注意每次GO应用前30 min使用地塞米松5 mg/m2或甲泼尼龙1 mg/kg;每次使用GO前需评估肝脏功能情况,警惕静脉阻塞性肝病,若出现肝中毒的症状应中断使用。
5.维奈克拉为基础的减低强度的化疗方案:如低剂量VAH方案、低剂量VAH+去甲基化药物方案,剂量同诱导治疗。也可以联合克拉曲滨5 mg/(m2·d),第5~10天。除此之外,也可应用阿糖胞苷为主联合阿克拉霉素、氯法拉滨等其他药物的方案。
七、靶向治疗
越来越多的研究表明在传统化疗药物的基础上联合靶向药物可提高缓解率及MRD转阴比例,但受限于不同国家、地区靶向药的可及性及其在儿童AML中的疗效及安全性尚不明确,本共识仅对以下几种靶向药作如下推荐。
(一)FLT3-ITD基因突变AML的靶向治疗
FLT3基因突变是儿童AML最常见的基因突变之一,与不良预后有关。第一代FLT3抑制剂(索拉非尼、米哚妥林等)为广谱多激酶抑制剂,脱靶效应明显,不良反应相对较大。第二代FLT3抑制剂(奎扎替尼、吉瑞替尼等)特异性和选择性更高,脱靶效应更少。目前只有米哚妥林和吉瑞替尼被美国食品药品监督管理局(food and drug administration,FDA)批准用于FLT3基因突变的AML患者。
1.索拉非尼:是VEGFR、KIT和FLT3的多靶点小分子抑制剂,其作为一线治疗的效果有限,多用于造血干细胞移植后维持治疗(仅限FLT3-ITD基因突变),主要不良反应为造血干细胞移植后移植物抗宿主病及皮肤毒性。
2.米哚妥林:2017年4月美国FDA批准米哚妥林用于FLT3-ITD基因突变初治AML患者的治疗。2项米哚妥林应用于儿童AML的Ⅰ、Ⅱ期临床试验(NCT03591510、NCT00866281)正在进行中。米哚妥林暂未获批在我国上市,因此除临床试验之外不推荐应用于儿童AML。
3. 吉瑞替尼:为一种高选择性二代FLT3抑制剂,通常不受激活环突变(例如D835点突变)的影响。2018年美国FDA批准吉瑞替尼用于具有FLT3基因突变的复发、难治AML成人患者,多项研究也证实其对儿童AML的有效性。吉瑞替尼相较奎扎替尼的骨髓抑制作用较弱,其与维奈克拉联合具有协同作用。应避免吉瑞替尼与P糖蛋白或细胞色素P450 3A酶(CYP3A)强抑制剂合用。
(二)GO
2017年美国FDA批准GO应用于CD33阳性AML的一线或是复发治疗,其血液学毒性尤其是持续性血小板减少及肝毒性需特别注意,基于GO的强化疗方案可能是挽救治疗、复发或难治性AML的可行选择。标准化疗联合GO可显著提高新诊断儿童AML的无事件生存率,降低FLT3-ITD基因突变AML及KMT2A基因重排AML的复发率。GO暂未在我国上市,除临床试验之外不推荐应用于儿童AML。
(三)B细胞淋巴瘤因子2(B-cell lymphoma-2,BCL-2)靶向治疗
维奈克拉是BCL-2选择性小分子抑制剂,BCL-2是凋亡通路的关键调控因子。2020年美国FDA批准维奈克拉联合阿扎胞苷、地西他滨和小剂量阿糖胞苷用于新诊断的75岁及以上的伴有严重并发症或不能耐受强化疗AML患者。2021美国国立综合癌症网络AML指南及“成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2023年版)”将维奈克拉用于不能耐受强化疗患者的减低强度化疗。维奈克拉联合其他药物用于儿童AML的有效性和安全性逐渐被证明。
维奈克拉是CYP3A、P糖蛋白的底物,若与CYP3A强、中效抑制剂合用,需调整维奈克拉剂量,停用CYP3A强、中效抑制剂2~3 d后恢复维奈克拉原方案剂量。此外,维奈克拉可增加华法林的血药浓度,可能增大出血风险,合用时应密切监测国际标准化比值。
八、造血干细胞移植
本共识推荐高危AML患儿若有合适配型,在完成2轮诱导治疗或1轮巩固疗程获得第1次完全缓解后,均应考虑行异基因造血干细胞移植;复发、难治AML患儿尽量在骨髓缓解、MRD转阴后行异基因造血干细胞移植,经历2轮及以上化疗仍不缓解者,征得家属同意情况下也可尝试造血干细胞移植。对于伴RUNX1::RUNX1T1融合基因的AML患儿,2轮巩固治疗后骨髓分子MRD下降小于3个log(一般基因定量≥0.4%)或强化治疗后基因由阴性转阳性者建议其行造血干细胞移植。
综上所述,儿童与成人AML遗传学特点、治疗反应及结局存在较大差异,临床诊治面临的挑战包括儿童AML生物学特点结合新型靶向治疗与传统化疗药物组合的优化、MRD监测及其对治疗及预后的指导、复发或难治儿童AML的治疗策略等。因此临床医师需认识儿童AML的特点综合评估以制定适宜的治疗决策及管理,儿童AML多中心研究协作组亦需根据循证医学证据每1~2年更新优化诊治方案以指导全国儿童AML的规范诊治,提高儿童AML的生存率和生存质量。
(郑胡镛 李静 王天有 执笔)
参与本共识制订的专家名单(按单位和姓名拼音排序): 北京清河医院(师晓东);重庆医科大学附属儿童医院(于洁);复旦大学附属儿科医院(翟晓文);广西医科大学第一附属医院(廖宁);广州市妇女儿童医疗中心(江华);贵州医科大学附属医院(何志旭);河南省儿童医院(刘炜);华中科技大学同济医学院附属同济医院(胡群);华中科技大学同济医学院附属协和医院(金润铭);昆明市儿童医院(田新);南方医科大学南方医院(冯晓勤);南京市儿童医院(方拥军);山东大学齐鲁医院(鞠秀丽);上海交通大学医学院附属上海儿童医学中心(陈静、沈树红);上海市儿童医院(蒋慧);深圳市儿童医院(马廉);首都医科大学附属北京儿童医院(李静、王天有、吴敏媛、张瑞东、郑胡镛);四川大学华西第二医院(高举);苏州大学附属儿童医院(胡绍燕);西安市儿童医院(刘安生);浙江大学医学院附属儿童医院(汤永民、徐晓军);郑州大学第一附属医院(刘玉峰);中国医学科学院血液病医院(中国医学科学院血液学研究所)(竺晓凡);中山大学附属第一医院(罗学群);中山大学孙逸仙纪念医院(方建培)
本文编辑:孙艺倩
