
编者按
转移性去势抵抗性前列腺癌(mCRPC)是前列腺癌的终末期阶段,预后较差,其治疗管理面临较大挑战。近年来,随着诊疗手段的进步和新药的发展,mCRPC患者有了更多的治疗选择,生存预后也得到了显著改善。在刚刚结束的2024年欧洲肿瘤内科学会(ESMO)年会上,mCRPC领域又迎来了诸多新的进展。本期“益腺学院”特邀中山大学附属肿瘤医院李永红教授,深入解读本届ESMO年会中mCRPC领域的重磅研究,分享其专业见解与实践经验。
专家简介


李永红 教授
中山大学附属肿瘤医院
中山大学附属肿瘤医院泌尿外科副主任、前列腺肿瘤病区主任
主任医师 、博士生导师
广东省杰出青年医学人才、羊城好医生
中国抗癌协会前列腺癌整合防筛专业委员会副主任委员
中国抗癌协会男生殖系肿瘤专业委员会委员
中国临床肿瘤学会前列腺癌专家委员会委员
中华医学会泌尿外科学分会男科学组委员
广东省抗癌协会泌尿生殖系肿瘤专业委员会副主任委员
广东省医学会机器人外科学分会常委、秘书
擅长前列腺癌外科手术及多学科综合治疗
第一/通讯作者在 European Urology、Cancer Research、Clinical Cancer Research 、Urology 、Prostate、PCPD 等杂志发表论文30余篇,研究成果被Campbell Urology、美国NCCN指南引用
主持国家自然科学基金面上项目等多项研究基金
Abstract LBA1 一项比较恩扎卢胺联合镭-223 vs 恩扎卢胺用于无症状或轻度症状的骨转移mCRPC患者一线治疗的随机、多中心、开放标签III期试验:EORTC-GUCG 1333/PEACE-3首次报告结果[1]
研究背景
PEACE-3是欧洲癌症研究与治疗组织(EORTC)发起的一项临床研究,旨在评估恩扎卢胺+镭-223(ENZ-RAD)较恩扎卢胺(ENZ)单药能否改善mCRPC患者的疾病进展。
研究方法
纳入有骨转移的mCRPC患者,按1:1比例随机分配至ENZ组或ENZ-RAD组。截至2018年3月,患者必须同时使用唑来膦酸或地舒单抗。主要终点为影像学无进展生存期(rPFS)。次要终点包括总生存期(OS)、至后续系统抗肿瘤治疗的时间(TTNT)、疼痛进展时间(TTPP)以及至首次症状性骨相关事件的时间(TTSSE)。
研究结果
2015年11月至2023年3月,共纳入446例患者。中位年龄为70岁,四分位距(IQR)65-76岁。中位随访时间为42.2个月;ENZ-RAD组中,87.9%完成了计划的6个周期镭-223治疗。两组rPFS的风险比(HR)为0.69(95%置信区间[CI]:0.54-0.87;p=0.0009),ENZ组的中位rPFS为16.4个月(95%CI:13.8-19.2),ENZ-RAD组为19.4个月(95%CI:17.1-25.3,图1)。
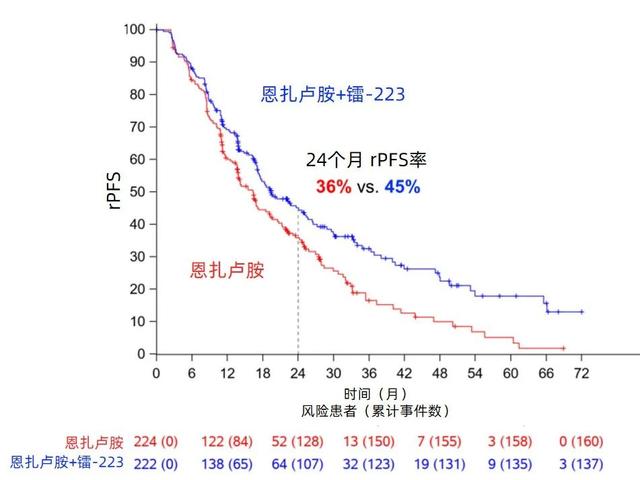
图1.两组患者的主要终点rPFS
两组OS的HR为0.69(95%CI:0.52-0.90;p=0.0031),在预设的中期分析中(基于80%事件发生),ENZ组的中位OS为35.0个月(95%CI:28.8-38.9),ENZ-RAD组为42.3个月(95%CI:36.8-49.1,图2)。研究将继续进行最终的OS分析。
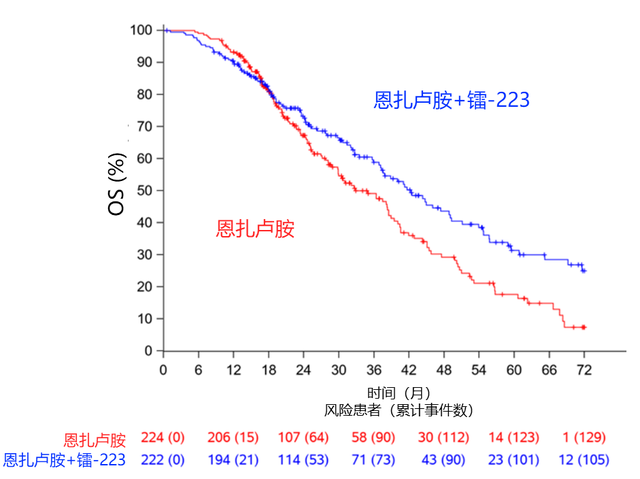
图2. 两组患者OS中期分析
对于其他次要终点,ENZ-RAD和ENZ组24个月时的TTNT比例有显著差异,分别为29.9%(95% CI:23.6%-36.4%)和50.9%(95% CI:43.6%-57.6%),HR为0.57(95% CI:0.44-0.75;p<0.0001)。而TTPP和TTSSE则无显著差异,HR分别为1.02(95% CI:0.77-1.36;p<0.5341)和0.93(95% CI:0.62-1.38;未正式比较p值)。
ENZ组和ENZ-RAD组分别有96.4%和100%的患者报告了≥1级的治疗期间出现的不良事件(TEAE),≥3级TEAE的发生率分别为55.8%和65.6%。ENZ-RAD组中,最常见的≥3级TEAE包括高血压(34%)、疲劳(6%)、贫血(5%)和中性粒细胞减少(5%)。ENZ-RAD组中任一≥3级TEAE的发生率较ENZ组增加均不超过5%。
研究结论
PEACE-3研究表明,作为mCRPC的一线治疗,恩扎卢胺联合6个周期的镭-223可显著延长rPFS。中期分析显示,ENZ-RAD联合方案在OS上有统计学意义的显著获益,研究将进行最终的OS分析以进一步确认这一结果。
李永红教授点评
mCRPC患者的治疗一直是临床研究的热点和难点,既往治疗手段有限。在临床中,超过90%的mCRPC患者存在骨转移,骨转移引发的疼痛严重影响了患者的生存质量[2]。此外,骨转移可导致骨相关事件,如病理性骨折、脊髓压迫等,从而缩短患者的总生存期。目前的骨靶向治疗未能明显改善骨转移患者的生存状况,而现有的放疗仅能在一定程度上缓解疼痛和延迟骨骼事件的发生[3]。因此,迫切需要新的治疗方法,以改善骨转移mCRPC患者的生存期和生活质量。镭-223是一种α粒子发射体,能靶向骨转移灶并释放高能量α粒子,从而有效杀伤肿瘤细胞。在III期ALSYMPCA研究中,镭-223显著改善了有骨转移症状的mCRPC患者的OS,并延迟了SSE时间,说明其不仅能缓解疼痛,还可延长患者OS,且耐受性良好。[3]
本次大会PEACE-3研究结果的发布引起了学术界的广泛关注,ENZ-RAD联合治疗组的中位rPFS达到了19.4个月,显著优于ENZ单药组的16.4个月,疾病进展风险降低了31%。同时,联合治疗组的中位OS也延长至42.3个月,较单药组提高了7个月[1]。尽管目前尚未进行最终分析,但ENZ-RAD作为一线治疗方案在改善mCRPC患者的生存方面已展现出相当的潜力。但我们也注意到,PEACE-3研究纳入的是既往未接受过ENZ治疗的患者,基线特征分析显示约有30%的患者在mHSPC阶段接受过多西他赛治疗,仅2%-3%的患者接受过阿比特龙治疗。而现在以ADT为基础的联合强化治疗已广泛前移至mHSPC阶段,而ENZ-RAD联合方案对于此类在mHSPC阶段已接受过新型内分泌药物治疗的mCRPC患者的疗效如何,目前尚不清楚。期待未来更多的研究数据和真实世界的经验为我们提供更多的证据。总之,PEACE-3研究突破性结果的公布无疑为mCRPC患者带来了新的希望。期待随着未来最终结果的公布,这一联合疗法有望成为mCRPC新的一线标准治疗方案,为医生和患者提供更有效的治疗选择。
Abstract LBA72 3 mg/kg纳武利尤单抗联合1 mg/kg伊匹木单抗(nivo3/ipi1)用于经分子筛选的mCRPC患者:INSPIRE研究[4]
研究背景
抗程序性死亡受体1(PD-1)免疫检查点抑制剂(ICB)单药治疗目前已被批准用于肿瘤突变负荷(TMB)大于10次突变/兆碱基(mut/Mb)或错配修复缺陷(MMRd)的mCRPC患者。PD-1/CTLA-4双免疫治疗似乎较单药治疗更有效,但其毒性限制了nivo3/ipi1在mCRPC中的广泛适用性。本研究探索了nivo3/ipi1在经分子选择的mCRPC患者中的疗效和安全性。
研究方法
此项单臂、II期试验纳入了69例MMRd、非同义TMB>7 mut/Mb(hTMB)、BRCA2突变(BRCA2m)或CDK12双等位基因失活(CDK12i)的mCRPC患者。在队列A中进行疗效评估,分别为有RECIST1.1(A1组)和PCWG3(A2组)标准下可测量病灶的ICB初治患者。在队列A和队列B(既往接受过ICB单药治疗)中进行安全性评估。患者共接受4个周期的nivo3/ipi1(每3周1次)治疗,随后接受纳武利尤单抗480 mg每4周1次的治疗,最长可达1年。主要终点为大于6个月时的疾病控制率(DCR>6),研究目标是DCR>6大于22%。
研究结果
患者于2021年1月至2024年2月期间开始接受治疗。中位年龄为69岁[范围50-82岁]。队列A共65例患者,其中,21例(32%)为MMRd,8例(12%)为hTMB,20例(31%)为BRCA2m,16例(25%)为CDK12i。mCRPC的既往中位治疗线数为1(范围0-5)。在数据截止时,中位随访时间为12个月(范围1-42个月)。总人群的DCR>6为38%(95% CI:27-51),DCR>6在MMRd患者中最高(81%),其次为hTMB(25%)、CDK12i(19%)和BRCA2m患者(15%)。客观缓解率(ORR)、PSA50(PSA较基线下降≥50%)和PSA90(PSA较基线下降≥90%)缓解率分别为38%、47%和41%。队列A的中位rPFS为4.0个月(95% CI:3.5-12.0),MMRd患者的中位rPFS高达32.7个月(95% CI:21.8-NR),详见表1和图3。
表1. INSPIRE研究中的DCR、ORR、PFS、OS等疗效终点

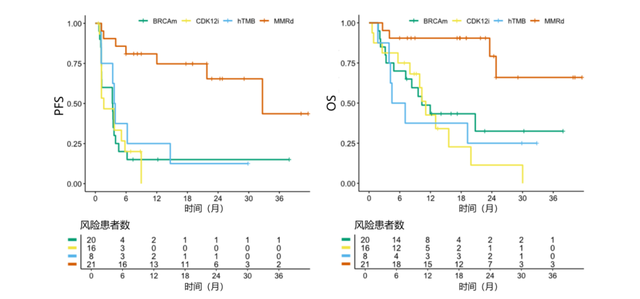 图3. 不同分子特征患者的PFS和OS
图3. 不同分子特征患者的PFS和OS
14例(20%)患者因治疗相关不良事件(TRAE)永久停药。33例(48%)患者发生≥3级TRAE,包括腹泻和转氨酶升高(各10%)。共2例治疗相关的死亡,一例为肠穿孔,另一例为4级毒性后实施的安乐死。
研究结论
这项双ICB用于经分子筛选的mCRPC患者的试验达到了其主要终点。在MMRd、hTMB、BRCA2m和CDK12i亚组中观察到了持久的获益。双ICB在dMMR患者中的疗效结果似乎优于既往报道的单ICB治疗的结果。
李永红教授点评
在过去十年中,以PD-1/PD-L1为代表的ICB无疑是肿瘤治疗领域最大的突破之一,改写了许多瘤种的治疗格局。然而,前列腺癌有着不同于这些肿瘤的特性,如激素依赖性、较低的肿瘤突变负荷和不利于免疫细胞的浸润和激活的肿瘤微环境等,从单药治疗到联合新型内分泌药物、PARP抑制剂等其他不同作用机制的药物,免疫治疗大多仅展现了有限的疗效,始终无法取得突破[5]。但研究者们始终没有放弃对前列腺癌免疫治疗的探索。
在CheckMate 650研究中,nivo3/ipi1双免疫方案在未经选择的mCRPC患者中显示出一定疗效,优于ICB单药[6]。本届ESMO大会发布的INSPIRE II期研究进一步探索了该方案在经过筛选,具有特定分子特征(包括MMRd、hTMB、BRCA2m和CDK12i)mCRPC患者中的疗效和安全性。通过对免疫优势人群的筛选,该研究达到了主要终点,在总人群中DCR>6达到38%。在肿瘤免疫治疗中,有效可行的生物标志物是至关重要的,而与其他多数实体肿瘤不同,PD-1/PD-L1表达水平在前列腺癌中并不是ICB治疗的可靠生物标志物,而既往研究表明,高TMB,MSI-H/MMRd以及存在同源重组缺陷基因(包括BRCA2、BRCA1、ATM、CDK12等)突变的患者往往能从ICB治疗中获益[5]。而在INSPIRE研究的多个生物标志物中,最亮眼的是MMRd组患者的治疗结果,其DCR>6高达81%,ORR为75%,PSA90缓解率为86%,中位PFS达到了32.7个月[4]。这一结果充分表明了精准筛选优势人群在mCRPC免疫治疗中的重要性。通过生物标志物筛选,医生可为患者提供更精准的治疗方案,为特定患者带来新的治疗希望。但另一方面,综合本研究中的患者筛选情况和既往的报告,MMRd在mCRPC患者中仅占约3%-5%[7],以此为生物标志物筛选,可能获益的人群仍十分有限,是否还有其有效的生物标志物是值得继续探索的问题。此外,双ICB疗法的安全性也是令人担心的问题。未来道阻且长,我们期待尽快看到免疫疗法在前列腺癌的治疗中真正取得一席之地的那一天。
Abstract LBA65 177Lu-PNT2002用于接受雄激素受体通路抑制剂(ARPI)治疗进展后的前列腺特异性膜抗原(PSMA)阳性mCRPC患者的疗效(SPLASH)[8]
研究背景
mCRPC存在大量未满足的治疗需求。177Lu-PNT2002([Lu 177]-PSMA-I&T)是一种针对PSMA的小分子放射性药物,与DOTAGA放射性金属螯合剂相连。本研究旨在评估177Lu-PNT2002在既往接受过APRI治疗的mCRPC患者中的疗效和安全性。
研究方法
SPLASH是一项开放标签的III期试验,纳入既往接受过一种ARPI后进展且mCRPC阶段未接受过化疗的PSMA PET阳性mCRPC患者。患者以2:1的比例随机分配至177Lu-PNT2002组(6.8 GBq,静脉注射,每8周一次,最多4个周期)或更换另一种ARPI组。主要终点为根据RECIST 1.1/PCWG3标准由盲态独立中心评估(BICR)的rPFS。其他关键终点包括OS、ORR、PSA50、健康相关生活质量(HRQoL)和安全性。经BICR确认疾病进展后,更换ARPI组的患者可交叉至177Lu-PNT2002组。
研究结果
在488例接受PSMA PET检查的患者中,90.4%为PSMA阳性;412例患者被随机分配至177Lu-PNT2002组(n=276,中位治疗4个周期)或更换ARPI组(n=136)。177Lu-PNT2002组和ARPI组的人口统计学和基线特征均衡:ECOG评分0分:58.7% vs. 55.9%;M0:10.1% vs. 11.0%。交叉率为84.6%(77/91)。与更换ARPI相比,177Lu-PNT2002显著改善了rPFS(9.5个月 vs. 6.0个月,HR=0.71,95%CI:0.55-0.92,p=0.0088,图4)。

图4. 两组患者的主要终点rPFS
177Lu-PNT2002组的ORR为38.1%,更换ARPI组为12%(p=0.0021)。两组中位缓解持续时间(DOR)分别为9.4个月和7.3个月(图5)。
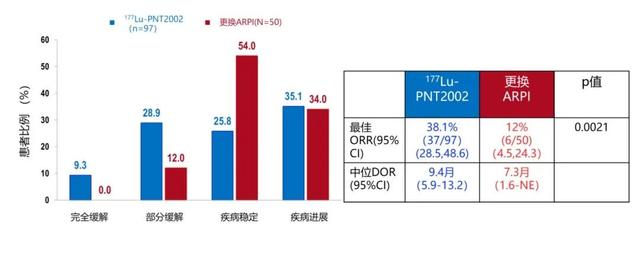
图5. 有基线可测量病灶患者的ORR和DOR
177Lu-PNT2002组和更换ARPI组的PSA50分别为35.7%(96/269) vs. 14.6%(19/130);中位无生化进展生存期(bPFS)分别为7.0个月和3.9个月(HR=0.58,95% CI:0.44-0.76,p<0.0001,图6)。

图6. 两组患者的bPFS
以FACT-P评分评估的至HRQoL恶化时间,177Lu-PNT2002和更换ARPI组分别为8.1个月(95% CI:8.0-NE)和5.3个月(95% CI:4.4-5.9),HR=0.59(95% CI:0.44-0.80,p=0.0005)。首次OS中期分析显示,177Lu-PNT2002和更换ARPI组的中位OS分别为20.8个月(95% CI:19.1-NE)和NE(95% CI:NE-NE),HR=1.11(95% CI:0.73-1.69,p=0.6154)。
在安全性方面,与更换ARPI组相比,177Lu-PNT2002组导致治疗中断的TEAE发生率和≥3级TEAE发生率均较低(1.9% vs. 6.2%,30.1% vs. 36.9%)。177Lu-PNT2002组最常见的TEAE为疲劳(53.5%)、口干(37.2%)和恶心(31.2%)。
研究结论
177Lu-PNT2002在PSMA阳性且未接受过化疗的mCRPC患者中耐受性良好,与换用另一种ARPI相比,改善了rPFS、ORR、PSA50和HRQoL。
李永红教授点评
在mCRPC患者中,接受一种ARPI治疗进展后更换另一种ARPI的疗效获益有限。而化疗由于毒副作用较大,对生活质量影响明显,患者接受意愿普遍不高,因此,ARPI治疗后进展的mCRPC患者存在着广泛未被满足的临床需求,亟需探索新的治疗手段和模式。
177Lu标记PSMA放射性配体疗法(177Lu-PSMA-RLT)是一种通过精准地向前列腺癌细胞递送177Lu释放的β射线,引发肿瘤细胞DNA的辐射损伤从而杀灭肿瘤的创新疗法。177Lu-PNT2002是一种正在临床研究阶段的PSMA-RLT药物,在本次大会报告的III期SPLASH研究中,与换用另一种ARPI相比,177Lu-PNT2002使在mCRPC阶段接受过ARPI但未接受过化疗的mCRPC患者的影像学进展风险降低了29%(中位rPFS:9.5个月 vs. 6.0个月,HR=0.71[95% CI:0.55,0.92];P=0.0088)。值得关注的是,177Lu-PNT2002具有良好的耐受性,≥3级不良事件发生率及TEAE发生率均低于ARPI组,接受177Lu-PNT2002治疗的患者中仅有1.9%因TEAE而停止治疗,而ARPI组中有6.2%的患者停止治疗[8]。良好的安全性对于通常年龄较大且身体状况不佳的mCRPC患者相当重要。
目前FDA已批准了177Lu-PSMA-617在mCRPC中的后线应用,SPLASH研究再次证明了PSMA-RLT在mCRPC中的价值。这是继177Lu-PSMA-617的PSMAfore III期试验成功后,PSMA-RLT再次显示了可以延缓未经化疗且接受ARPI治疗后进展的mCRPC患者的疾病进展。尽管SPLASH试验的OS数据尚未成熟,但以目前的疗效数据和其良好的安全性看,177Lu-PNT2002或可为此类mCRPC患者提供一种新的治疗选择。随着RLT在mCRPC中的价值逐渐确认,其研究也在向更早期的疾病阶段发展,本次大会也公布了177Lu-PSMA-617的UpFrontPSMA II期研究的结果,首次证明了在标准治疗多西他赛二联方案的基础上加用PSMA-RLT可改善初治高危mHSPC患者基于PSA的治疗结果[9]。这让我们对PSMA-RLT在前列腺癌治疗中的未来抱有更多期待,相信随着研究的深入,临床应用的增多和跨学科合作的加强,核素药物这一新的治疗手段也将在前列腺癌领域发挥更重要的作用。
小结
mCRPC是前列腺癌治疗的难点,具有较高的分子异质性,且与多种基因组改变密切相关,因此需要多机制、多靶点的治疗手段。针对mCRPC的治疗需要深入研究和不断地创新,以应对其分子异质性和复杂的生物学特性。未来期待更多生物标志物的发现和新型治疗手段的涌现,拓展mCRPC精准治疗的获益人群,为更多前列腺癌患者带来生存获益。
参考文献
[1] Silke Gillessen, et al. A randomized multicenter open label phase III trial comparing enzalutamide vs a combination of Radium-223 (Ra223) and enzalutamide in asymptomatic or mildly symptomatic patients with bone metastatic castration-resistant prostate cancer (mCRPC): First results of EORTC-GUCG 1333/PEACE-3. ESMO 2024 LBA1.
[2] Body JJ, et al. Targeting bone metastases in prostate cancer: improving clinical outcome. Nat Rev Urol. 2015 Jun;12(6):340-56.
[3] Parker C, et al. Alpha Emitter Radium-223 and Survival in Metastatic Prostate Cancer. N Engl J Med. 2013 Jul 18;369(3):213-23.
[4] N. Mehra, et al. Nivolumab 3mg/kg and ipilimumab 1mg/kg (nivo3/ipi1) in molecularly selected patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). ESMO 2024 LBA72.
[5] 何华东,李昶灸.免疫检查点抑制剂治疗转移性去势抵抗性前列腺癌的研究进展[J].浙江医学,2021,43(24):2613-2618.
[6] Sharma P, et al. Nivolumab Plus Ipilimumab for Metastatic Castration-Resistant Prostate Cancer: Preliminary Analysis of Patients in the CheckMate 650 Trial. Cancer Cell. 2020 Oct 12;38(4):489-499.
[7] Abida W, et al. Analysis of the Prevalence of Microsatellite Instability in Prostate Cancer and Response to Immune Checkpoint Blockade. JAMA Oncol. 2019 Apr 1;5(4):471-478.
[8] O. Sartor,et al. Efficacy of 177Lu-PNT2002 in PSMA-positive mCRPC following progression on an androgen-receptor pathway inhibitor (ARPI) (SPLASH). ESMO 2024 LBA65.
[9] A.A. Azad,et al. UpFrontPSMA: A randomised phase II study of sequential 177Lu-PSMA-617 and docetaxel (D) versus docetaxel in metastatic hormone-sensitive prostate cancer (mHSPC). ESMO 2024 LBA66.
声明
本视频/资讯/文章是由益普生医学团队编辑/医疗卫生专业人士撰写提供,旨在用于医疗卫生专业人士间的学术交流,不支持以任何形式转发给非医疗卫生专业人士;如有违反,责任自负;转发给其他医疗卫生专业人士时,也请自觉保护知识产权。
本视频/资讯/文章的内容不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。内容中出现任何药品并非为广告推广目的,医疗卫生专业人士如进行处方,请严格遵照该药品在中国批准使用的说明书。益普生不承担任何相关责任。
DIP-CN-012393 有效期至2025年10月8日
审核:Kristen
排版:Gardenia
执行:Gardenia
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。

