*仅供医学专业人士阅读参考


肠道菌群圈好久没出现如此激动人心的研究成果了。
近日,由欧洲分子生物学实验室(EMBL)Jamie A. Hackett领衔的研究团队,在顶级期刊《自然》上发表一项重磅研究成果[1]。
他们发现,雄性小鼠的肠道菌群失衡会被精子“记录”,进而增加子代小鼠出生体重过低和过早死亡的风险。据了解,这也是科学家首次发现雄性哺乳动物的肠道微生物变化会影响自身的生殖系统和子代的健康和寿命。
如果上述发现在人体中证实,生殖健康领域的肠道微生物研究,就要从“母亲-新生儿”模式,转变成“母亲-父亲-新生儿”模式了。这一发现也意味着,各位准爸爸不仅要戒烟戒酒锻炼身体,还得注意用药和饮食,保护肠道微生物的健康。

▲ 论文首页截图
肠道微生物对人体健康的影响是非常复杂的。
大量的研究将肠道与脑、皮肤、骨、脂肪、肝脏、心脏、肾脏和肺等组织器官联系起来,构成众所周知的肠X轴。

▲ 复杂的肠X轴示例[2]
Hackett团队注意到,肠道微生物群对生殖系统的系统性影响,以及由此对后代的影响,目前尚未被探索。
为了解决上述问题,Hackett和他的同事使用非吸收性抗生素(nABX)构建了肠道微生物群失调的小鼠模型。由于nABX不能被胃肠上皮吸收,因此生殖系统发生的变化都应被看作肠道微生物失衡带来的,而不是抗生素全身性暴露导致的。
他们将雄性小鼠分成三组,一组服用6周nABX,然后与未经抗生素处理的雌性交配;一组先服用6周nABX,然后停4周让肠菌恢复,再与未经抗生素处理的雌性交配;第三组先服用6周nABX,然后停8周让肠菌恢复,再与未经抗生素处理的雌性交配。通过研究三组小鼠子代(F1)的情况,就可以了解肠菌对生殖系统及后代健康的影响。

▲ 处理方式(左)及肠菌变化(右)
咱们先来看看仅服用6周nABX的雄性小鼠的后代发生了哪些变化。
与对照组(雄鼠未经抗生素处理)的后代相比,nABX处理6周小鼠的后代无论是雄性还是雌性,出生体重都显著较低,而且在后续的发育过程中持续偏低;甚至还有部分后代出现严重生长受限(SGR)的表型。
最让Hackett团队震惊的是,nABX处理6周小鼠后代的产后死亡率显著增加。这一现象主要发生在严重生长受限的小鼠群体中。

▲ 产后死亡率显著增加
在分析那些严重生长受限子代小鼠的转录组数据之后,Hackett和他的同事发现,在它们的大脑和棕色脂肪组织(BAT)中分别检测到2973和1563个差异表达基因(DEGs),而且这些DEGs优先富集于与代谢过程有关的通路。
在另一组抗生素组合或泻药聚乙二醇(PEG)的处理下,Hackett团队复现了他们的研究数据。因此,他们认为,因此,准爸爸的肠道微生物群失衡会增加后代出现发育障碍和过早死亡的风险,这一结果也支持诱导的雄性肠道菌群失调与后代健康之间存在直接联系。

▲ 研究结果被复现
在证实二者之间的直接相关性之后,Hackett团队探讨了另一个重要问题,停止抗生素干预且肠道菌群恢复之后,不利影响会消失么?
此时就要用到nABX处理6周后停药4周或8周的雄性小鼠模型了。从研究结果来看,停药四周的雄性小鼠肠菌没有完全恢复正常,它们的后代也出现了出生体重低和严重生长受限的表型,以及过早死亡风险增加。
好消息是,在停药8周(小鼠的精子形成周期是5周)后,雄性小鼠肠道菌群基本恢复到正常状态,它们的后代出身体重正常、发育正常,早夭的风险也没有升高。这说明,肠道失衡对后代的影响是可以消除的。

▲ 肠道菌群失衡对后代的不利影响可以被消除
Hackett团队在分析严重生长受限小鼠的全基因组数据之后,发现与对照组相比,基因的结构变异、单核苷酸多态性(SNPs)或小插入/缺失(INDELs)突变的负荷没有增加。这也意味着,肠道菌群失衡给后代带来的不利影响不能隔代传播。
最后一个重要问题是,父亲肠道菌群的失衡究竟是如何影响后代发育的。Hackett团队首先排除了母亲的中介作用,因为小鼠生活在一起的时候,会出现肠道菌群的相互干扰。通过多种试验手段,以及体外受精技术(IVF),Hackett和他的同事证实,父亲肠道菌群失衡对后代的影响,与母体无关,是通过影响精子实现的。
以上结论让Hackett和他的同事回头研究抗生素处理后的雄性生殖系统和精子。从解剖学结果来看,与对照组相比,抗生素处理小鼠的睾丸质量显著减小,以及部分曲细精管发生了结构性变化(包括部分生殖细胞缺失形成的空泡)。显然,睾丸的生理功能受到了肠道微生物群失衡的影响。

▲ 抗生素处理对雄鼠睾丸的影响
随后,他们还从代谢组学和转录组学的角度研究了雄鼠的睾丸组织,从表观遗传学和小RNA角度研究了精子。
从研究结果来看,抗生素处理导致的肠道微生物失衡会导致睾丸环境发生重大变化,包括代谢物、生理学和激素水平的改变。Hackett团队认为,这表明哺乳动物体内确实存在一个肠道-生殖系统轴。在精子层面,虽然DNA甲基化相对稳定,但精子中的小RNA组成会随着nABX介导的菌群失调而改变。

▲ 精子的变化
最后,Hackett和他的同事还注意到,精子的这些变化,最终都反应在胚胎上。与对照组相比,nABX处理后的雄性精子发育的成熟胚胎在转录组层面存在348个差异表达基因(DEGs),上调的DEGs与类固醇代谢有关,而下调的DEGs与糖酵解有关。
值得注意的是,DEGs中还包括几个对胎盘发育很重要的因子的下调,例如Plgf、Hand1和Syna等,这表明胎盘发育受损。
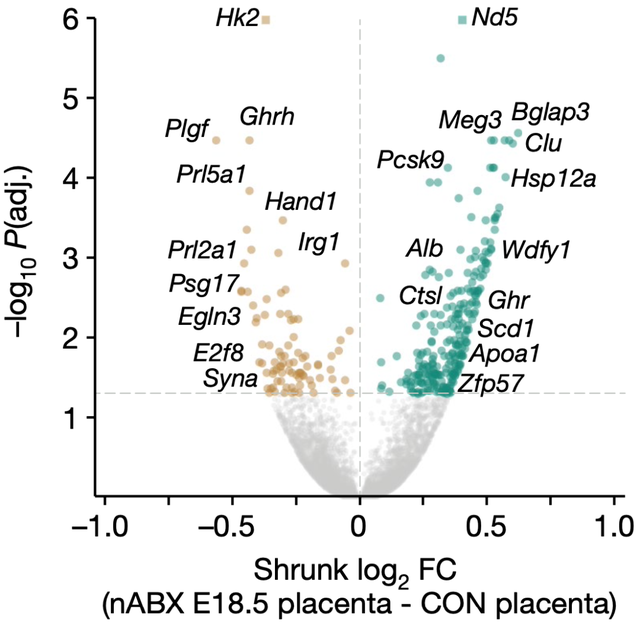
▲ 胚胎基因表达受到的影响
从胎盘的结构来看,nABX处理后的雄性精子发育的胚胎胎盘迷宫区(迷宫区是胎盘功能紊乱的常见根本原因)的显著减少,还可以观察到血管化显著受损,胎盘梗死增加,以及胎盘生长因子(PLGF)激素的水平显著降低。

▲ 胎盘的变化
总的来说,Hackett团队的研究成果首次证实,在哺乳动物体内,肠道微生物的失衡会影响生殖系统,进而影响精子质量,最终影响新生儿的健康和寿命。好消息是,肠道菌群恢复正常之后,上面的不利影响也会消失。
未来科学家需要在这个研究的基础上,进一步探索这种现象的背后分子机制,以及是否存在于人体内。还有个重要的问题是,男性在接受抗生素治疗之后,肠道微生物会在多长时间内恢复正常。这些探索对于未来的生殖健康有重要意义。
很多人可能很关心,在上述问题被解答之前,我们准备生育下一代的男性能做些什么呢?仅总这个研究来看,咱们至少可以保证备孕前几个月不用抗生素,这样可以最大限度地降低肠道微生物失衡对精子的潜在影响。
实际上,男同胞们需要注意的远远不止这些。早在2017年,发表在《美国医学会杂志》(JAMA)上的一篇文章就指出,男性不要以为自己仅仅提供了一个精子,就可以不管不顾;实际上,他们抽的烟、喝的酒、吃的炸鸡等,都会通过表观遗传学的形式刻在精子里,影响后代的健康[3]。
参考文献:
[1].Argaw-Denboba A, Schmidt TSB, Di Giacomo M, et al. Paternal microbiome perturbations impact offspring fitness. Nature. Published online May 1, 2024. doi:10.1038/s41586-024-07336-w
[2].Ahlawat S, Asha, Sharma KK. Gut-organ axis: a microbial outreach and networking. Lett Appl Microbiol. 2021;72(6):636-668. doi:10.1111/lam.13333
[3].Abbasi J. The Paternal Epigenome Makes Its Mark. JAMA. 2017;317(20):2049-2051. doi:10.1001/jama.2017.1566
注:文章头图来自于欧洲分子生物学实验室(EMBL)Joana Carvalho/Isabel Romero Calvo


本文作者丨BioTalker
