AB-729是一种在研乙肝小干扰RNA(siRNA),由杨梅生物制药公司(Arbutus Biopharma)研发,正在2a期临床研究中。2022年欧肝会(EASL2022)带来了与AB-729相关的多份新进展。

乙肝在研新药AB-729,未见病毒反弹,48周后24周随访积极数据
研究人员介绍,使用在研乙肝新药AB-729治疗48周后,在乙肝表面抗原水平较低的慢乙肝受试者中,停止核苷(酸)类似物(NA)治疗后观察到病毒标志物的持续抑制。AB-729,是一种 N-乙酰半乳糖胺 (GalNAc) 偶联单触发RNA干扰治疗剂,可靶向所有HBVRNA转录物,包括HBx,导致病毒复制和所有病毒抗原受到抑制。
目前,AB-729正在与其他抗病毒药物进行联用治疗慢性乙肝(CHB)的第2期临床试验中。AB-729-001 研究评估了长达 48 周的 AB-729+核苷类(NA)的组合疗法。本研究中,研究人员报告了符合方案资格标准并在最后一剂 AB-729 后至少24周选择停止核苷类治疗的受试者的早期随访数据!
参与 AB-729-001 研究的受试者,按照每4周(Q4W)、8周(Q8W)或 12周(Q12W)接受 60毫克或90毫克剂量的AB-729,持续48周,在他们最后一次使用AB-729后至少24周,评估是否有资格停用核苷类药物治疗。
停用核苷类药物标准包括 ALT < 2 × ULN、乙肝e抗原阴性、HBVRNA检测不到和两项单独检测乙肝表面抗原(HBsAg)< 100 IU/mL。在停用核苷类后,每 2-4周评估一次安全性和 PD,包括HBVDNA、HBsAg、HBVRNA和HBcrAg。
到目前为止,AB-729-001 研究中已有 27 名受试者,在最后一次注射AB-729后完成了至少 24 周的随访工作。其中,有 7 名符合停用核苷类药物的所有资格标准,这7名中有5名(5/7)同意停止所有治疗。
这些停用核苷类的受试者,他们的平均年龄为 45岁(范围33-59),3/5为女性,4/5为亚洲人,有 1名受试者分布在E队列中(60毫克组 Q4W),3名分布在F队列中(60毫克 Q8W),有 1名分布在 I队列中(90毫克 Q8W)。其中,3名服用恩替卡韦,2名服用富马酸替诺福韦二吡呋酯。
在研究开始时,所有受试者的乙肝e抗原均为阴性,乙肝表面抗原水平平均为 2886.8 IU/mL(范围 1392-6765),乙肝核心抗原水平范围为 < 3.0 至 4.2 log10 U/mL。在停用核苷类前的最后一次就诊时(最后一次AB-729 给药后至少24周),乙肝表面抗原水平平均为 30.49 IU/mL(范围 3.95-69.1),乙肝核心抗原水平范围为 <3.0 至 4.5 log10 U/mL。
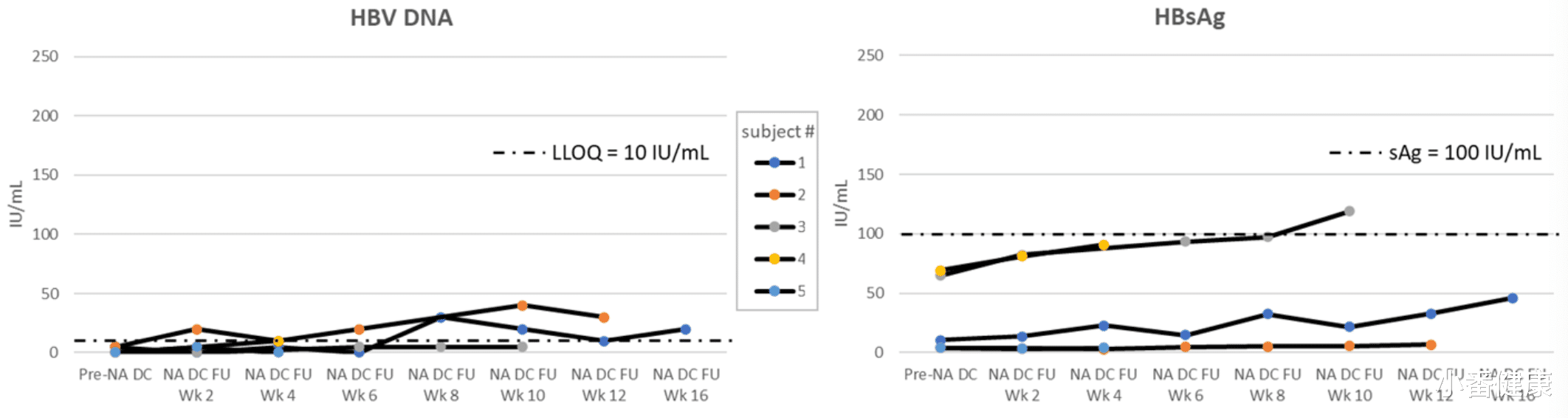
迄今为止,所有这 5 名受试者已完成了 4 至 16 周的NA治疗随访,且没有受试者符合临床或病毒复发标准。未报告 AEs,未观察到ALT升高,HBVDNA水平保持在 <LLOQ(3名受试者)或暂时升高至 30 或 40 IU/mL,随后在 2 名受试者中未经干预而下降。这所有 5 名受试者的乙肝表面抗原水平,仍远低于研究前水平!(可见上图)
综上所述,研究人员给出结论是:在使用 AB-729 诱导的乙肝表面抗原抑制至 <100 IU/mL后,停用核苷类药物治疗似乎具有良好的耐受性,并导致 HBVDNA 和乙肝表面抗原的持续抑制,没有早期临床或病毒复发的证据!这些受试者(以及本研究中可能在未来停用核苷类的任何其他受试者)将在NA停用后接受至少48周随访,以评估持续的病毒反应和功能性治愈的证据。

小番健康结语:2022年欧洲肝脏研究年会上,研究人员带来了多份在研乙肝新药 AB-729 新临床开发数据,这篇也是小番健康介绍过的与AB-729发表于本届年会上最后一份新进展。新进展描述的是,在长达48周 AB-729+核苷类 的组合疗法并随访24周中,已有 27人完成本研究,有 7 人符合停用核苷类药物的标准,7人中有 5 人同意停止所有治疗,而这 5 人都没有出现临床上早期病毒复发证据!他们还将继续停用核苷类,并接受更长时间的随访(48周),来继续评估能否实现功能性治愈HBV。
这份新的临床开发数据,继续说明基因沉默疗法在诱导乙肝表面抗原等病毒标志物强效抑制的同时,可维持持续抑制作用,尚未关注到任何早期病毒复发的证据!
AB-729是一种研究性HBV-siRNA,由杨梅制药科学家开发,目前正处于 2a期。
