文:回溯档案
编辑:回溯档案
微生物在许多真核宿主生物中发挥着重要的功能,了解植物生态位水平微生物组的变化对于更好地了解微生物组的结构和功能过程如何影响整个植物全生组的健康至关重要。
使用胡杨树作为模型生态系统,使用 16S 和 ITS2 rRNA 基因分析,对复制的三角叶杨和混合毛果杨 × 三角叶杨个体中 30 个不同组织水平生态位的古菌/细菌和真菌微生物组进行了表征。

微生物群落组成随栖息地和树木基因型的变化而变化
在采样的四个广泛栖息地中,我们发现古菌/细菌和真菌群落组成存在显著差异,群落组成的少量变化也可以通过基因型和栖息地 × 基因型相互作用来解释。
古菌/细菌 α 多样性在土壤生境中最大,在树叶生境中最低,茎和根具有相似的细菌 α 多样性估计值,茎中的真菌α多样性高于叶或根生境中的真菌α多样性,而土壤中的真菌α多样性也高于根中的真菌α多样性,古菌/细菌 α 多样性在杨树基因型之间没有差异,但我们发现杨树基因型之间的 α 真菌多样性存在显著差异,P. deltoides的真菌多样性高于杂交种。

在每个广泛的栖息地中,更精细尺度的栖息地的主要影响比基因型或其相互作用解释了更多的变异,除了对于叶真菌群落,基因型比生态位更能解释叶真菌群落组成的变化。

此外,在叶、根和土壤群落中,生态位对古菌/细菌组成的影响比真菌更大,而在茎群落中,生态位解释了与古菌/细菌群落相比真菌群落的更多变化,基因型的主要影响通常解释了特定生态位中古细菌/细菌和真菌的相似数量的变异。
叶子群落除外,每种广泛组织/栖息地类型内的生态位之间的古菌/细菌多样性也存在差异,但跨广泛组织/栖息地类型的每个生态位内的基因型之间没有差异,除根外,广泛生境类型内的生态位之间的真菌多样性有所不同,此外,叶、茎和根群落内的生态位在基因型之间的真菌多样性有所不同,其中平均而言,与杂交种相比,具有更高的真菌多样性。

不同栖息地和树木基因型的门水平差异
这 21 个主要古菌/细菌门中的 20 个在广泛的生境中存在差异,梭杆菌是唯一在这些栖息地中没有差异的优势门,Crenarchaeota、Firmicutes、Nitrospirae、AD3 和 WS3 在土壤中的丰度高于在根、茎和叶中的丰度。

最常见的古菌门——Crenarchaeota,在所有测试的栖息地中都存在显着差异,Crenarchaeota 在叶子中的相对丰度为 0.3%,在茎中的相对丰度为 0.1%,在根中的相对丰度为 0.2%,在土壤中的相对丰度为 3.0%,与其他生境相比,酸杆菌、绿屈菌、浮霉菌、疣微菌和 Deltaproteobacteria 在土壤中的丰度最高,但在根中的丰度也高于在茎和叶中的丰度。

Gemmatimonadetes 在土壤中的丰度最高,与茎组织相比,根生境的丰度更大,与叶子和土壤生境相比,拟杆菌门在根和茎中的丰度最高,而与所有其他生境相比,TM7 在根生境中的丰度最高。
放线菌和绦虫在土壤、根和茎中的丰度高于在叶子中的丰度,而 TM6 在土壤、根和叶子中的丰度高于在茎生境中的丰度,FBP 门在干组织中丰度最高,α变形菌在干组织中的丰度也最高,与根和土壤相比,叶子中的 Alphaproteobacteria 更丰富。

与土壤生境相比,根组织中的 Alphaproteobacteria 更丰富,β变形菌在土壤和根中比在叶或茎中最丰富,与茎相比,叶子富含β-变形菌,根和叶中的伽马变形菌含量高于土壤和茎生境中的含量,放线菌在P. deltoides相关组织/栖息地中更丰富,而 TM7 在杂交种中更丰富。

不同树木基因型的功能真菌行会和 OTU 差异
几个功能行会的相对丰度因基因型而异,在土壤中,一个功能行会因基因型而异,与P. deltoides相比,杂种基因型中的土壤腐生菌的相对丰度更高,但土壤腐生菌的平均丰度较低,在根中,杂种基因型中未定义的病原体较多,但丰度非常低。
在茎中,低丰度公会,例如动物病原体更多,但丰富的植物病原体大约为与杂交基因型相比,P. deltoides的含量高出 2 倍,叶子含有较多的动物病原体 ,与杂交植物相比,P. deltoides组织中未定义的腐生菌。

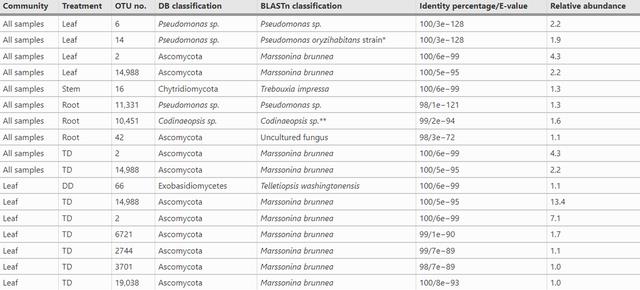
有趣的是,植物病原体相对丰度在叶组织中的基因型之间没有差异,细菌和真菌中检测到的几个 OTU 在不同栖息地和基因型之间存在显着差异,在广泛的栖息地类别中,有四个 OTU 代表叶子栖息地,特别是假单胞菌属,和与子囊菌门分类学亲和力最高的 OTU 。
BLASTn 证实了这些分类并将子囊菌门 OTU 鉴定为Marssonina brunnea,在茎生境中发现了一种真菌指标,使用 UNITE 分类为壶菌门,但在 BLASTn 中分类为单细胞藻类,因此该 OTU 可能是一种污染物,根组织存在三个指示类群——假单胞菌属、棒甲属sp.,和未培养的子囊菌。

相同的两个真菌 OTU是叶组织的指标,也是所有广泛生境类别中 P. trichocarpa × deltoides杂种的指标,在叶群落内,一些真菌 OTU 是杂交基因型组织的指标,并通过 BLASTn 分类为Marssonina brunnea,此外,一种真菌 OTU是P. deltoides叶组织的指示剂,最后,在茎群落中,有两种细菌 OTU—— Curtobacter flaccumfaciens和Elsinoebanksiae——是杂种茎组织的指标。
两种壳针孢属的相对丰度,和Marssonina brunnea是常见的杨属病原体,在叶位和基因型方面存在差异,值得注意的是,两种潜在的真菌病原体在杂交分株中的相对丰度显着更高。
栖息地选择效应
植物相关微生物群落的组装可能是由基于生态位的过程驱动的,特别是植物遗传因素、通过组织水平选择获得或随机性,以及这些栖息地类别内的 微生物多样性和群落组成存在显着差异。
这与我们的假设一致,即微生物群落在所调查的植物生态位中会有所不同,并且可能是由于在不同生境中定居的区域物种库的差异和生态位划分为微生物生活史差异的结果。

作为对群落组成的控制,归因于栖息地或植物组织类型的变化表明微生物组分化的生物或非生物驱动因素的强度,跨栖息地的微生物成员的选择可能是由于与杨属生化产品的相互作用,通过促进植物生长的微生物实现互利共生,或与地下组织相比,地上组织内的非生物因素存在巨大差异。

后者可能与不同栖息地的古菌/细菌和真菌多样性的差异特别相关,与细菌相比,真菌物种通常更能耐受干燥,可以在恶劣环境下增殖,由于胁迫耐受性,或者真菌生态位要求的更多重叠,地上组织内的真菌群落可能存在更大程度的共存。

杨树基因型效应
在P. deltoides和P. trichocarpa × deltoides基因型之间,我们观察到广泛栖息地类别内真菌多样性和组成的显着差异,这可能是由杂交树中更大的真菌病原体丰度驱动的,虽然在研究之前对该地点进行了粗略检查,发现树上存在典型的壳针孢属茎溃疡病,但杂交树中壳针孢属和Marssonina OTU 的高病原体负荷和共现情况令人惊讶,而且并非如此。
在分子分析之前就已经认识到,因为我们假设叶斑也是由壳针孢属,由于美国东部的共同进化, P. deltoides对某些同域真菌病原体具有抗性,而在美国西部,由于缺乏共存病原体,杂交树很容易受到影响,事实上,壳针孢属茎溃疡病造成的严重损失和马索尼娜叶斑病造成的过早落叶是杂交杨树在美国东部与为纸浆和造纸工业种植杂交杨树的美国西部不具有商业可行性的主要原因。

这些真菌病原体会引起叶斑和茎溃疡,但我们的结果还表明,它们栖息在植物周围的土壤中并在根组织中定殖,尽管这些栖息地的相对丰度明显较低,杂交树中的真菌病原体侵入宿主组织,并可能在竞争中胜过其他真菌物种,导致杂交真菌微生物组的多样性降低,这种模式在杂交树的叶子组织中很明显,其中Marssonina brunnea OTU 的丰度更高。
然而,值得注意的是壳针孢属,三角树和杂交树 的组织中也存在,但仅在杂交树中表现出疾病症状,在杂种叶组织中,Septoria OTU 的丰度也比Marssonina OTU 低得多,这表明这些病原体都能够定植和共存,但Marssonina可能有生态策略,使其更容易在叶子栖息地定殖并增殖。

结语
杨树木本植物系统提供了一个相关模型来研究微生物群落在组织水平生态位中的变化,总体而言,这项研究证明了基于生态位的过程如何驱动树种内的微生物组组成和多样性。
此外,这项研究表明微生物-微生物相互作用在微生物群落组成中的潜在重要性,真菌病原体的存在表明,真菌病原体可能会改变栖息在杂交杨树中的微生物,然而,虽然我们怀疑病原体在构建这些群落中发挥着不成比例的作用,但未来的研究需要使用密切相关的病原体抗性和易感性来更仔细地解决这一假设,杨树基因型。
参考文献
【1】Pii Y,Mimmo T,Tomasi N,Terzano R,Cesco S,Crecchio C,根际微生物相互作用:促进植物生长的根际细菌对养分获取过程的有益影响,回顾,生物肥料土壤,2015;51:403–15。
【2】de Zelicourt A、Al-Yousif M、Hirt H,根际微生物是植物耐逆性的重要伙伴,摩尔工厂,2013;6:242–5。
【3】Berendsen RL、Pieterse CMJ、Bakker PAHM,根际微生物组和植物健康,植物科学趋势,2012;17:478–86。
【4】Coleman-Derr D、Desgarennes D、Fonseca-Garcia C、Gross S、Clingenpeel S、Woyke T、North G、Visel A、Partida-Martinez LP、Tringe SG,植物区室和生物地理学影响栽培和本地龙舌兰物种的微生物组组成,新植醇,2016;209:798–811。
【5】Vandenkoornhuyse P、Quaiser A、Duhamel M、Le Van A、Dufresne A,植物全生物微生物组的重要性,新植醇,2015;206:1196–206。
