文:回溯档案
编辑:回溯档案
植物的所有气生器官均源自茎尖分生组织(SAM),它是农作物地上生物量来源的基础,器官的原基产生于SAM的外围,并在营养生长阶段发育成叶,或在生殖生长阶段发育成花 。
在双子叶被子植物中,SAM可分为三个区:中央区(CZ)、组织中心(OC)和外围区(PZ),中心区包含三层(L1-L3)多能干细胞。CZ正下方是OC,这是一个带有调节干细胞维持信号的分区。
来自CZ的子细胞横向转移到PZ中,在那里它们增殖并最终在器官发生过程中分化,III类同源域亮氨酸拉链(HD-ZIPIII)转录因子(TF)家族是植物界所独有的;它在调节胚胎模式、分生组织形成、器官极性、血管发育和分生组织功能中发挥着重要作用。
对HD-ZIPIII家族成员功能缺失等位基因的研究表明,REV基因的缺失会导致顶端和腋生分生组织发育明显缺陷,例如缺乏腋生分生组织、分枝减少、花结构发育不全甚至不育。rev /phb/phv三重突变体显示出增强的缺陷表型。

表明REV、PHB和PHV在调节SAM形成中的功能冗余。ATHB8和CAN在某些组织中拮抗REV,但在其他组织中与REV重叠。
棉花(Gossypiumhirsutum)是一种重要的经济作物,具有不确定的生长习性,为了平衡其营养生长和生殖生长,中国棉花生产过程中经常对主茎进行人工打顶(去除生长尖)。
然而由于近几十年来劳动力减少和劳动力成本上升,迫切需要开发更高效的技术,例如生物打顶,以取代手工打顶,在本研究中,我们克隆并鉴定了棉花中AtREV基因的四个同源物(GhREV1、GhREV2、GhREV3和GhREV4)。
并发现GhREV2是SAM发展的关键调节因子。这些结果为开发控制棉花主茎生长的生物措施提供了线索。
植物材料和生长条件
本研究使用陆地棉cvCCRI41和Xinshi17进行农杆菌介导的病毒诱导基因沉默(VIGS)和定量实时聚合酶链反应(qRT-PCR)测定,种子在沙子中发芽,4天后转移到装有5LHoagland溶液的盆中(每盆12株幼苗)。

实验在温室中进行,温度为24±2°C(白天)/20±2°C(夜间),相对湿度为60%,光照强度为400μmol·m?2·s?1,光照周期为14h(亮)/10h (暗)。
营养液每4天更换一次。拟南芥幼苗在22°C、相对湿度60%、80μmol·cm ?2 ·s ?1的培养箱中生长用于原生质体瞬时测定的14小时(光)/10小时(暗)光周期的光。

蛋白质系统发育树和序列分析
中的基本局部比对搜索工具(BLAST)搜索棉花中的HD-ZIPIII同源物,下载相应的氨基酸序列,使用MEGA5中的邻接方法构建了棉花和拟南芥中HD-ZIPIII同源物的系统发育树,进行序列比较分析。

RNA提取和qRT-PCR
收集棉花幼苗样品,用于第六叶期GhREV的组织特异性表达。VIGS-GhCLA1植物显示第一片和第二片真叶完全漂白后,收集VIGS处理棉花的芽尖样品。样品立即冷冻在液氮中并储存在-80°C。
使用植物RNA快速提取试剂盒从样品中分离总RNA,然后反转录成cDNA,通过qRT-PCR检测植物中GhREVs、GhWUS10A和GhSTM的表达。
转录活性测定


添加UBQ10-GUS作为转染效率的内部对照,孵育12h后,用酶标仪检测荧光素酶报告基因的活性。
亚细胞定位
GhREV2蛋白的亚细胞定位是在拟南芥原生质体中进行的,使用Sma I和Kpn通过限制性内切酶将GhREV2的全长cDNA克隆到pSuper1300载体中,以生成pSuper:: GhREV2-GFP,将融合的构建体转化或共转化到原生质体中12小时。通过共焦显微镜检查荧光。
扩增GhREV2的330bpcDNA片段并克隆到pYL156载体中,通过电穿孔将二元TRV载体pTRV: RNA1和pTRV: RNA2 的质粒转化至根瘤农杆菌菌株GV3101中,如先前所述,培养农杆菌菌株用于VIGS测定,使用无针注射器将农杆菌菌株的混合物渗透到两个完全展开的子叶中。

数据通过独立重复进行汇集。使用单因素方差分析(ANOVA)进行统计分析,并使用Duncan多重范围检验比较处理平均值,P ?<0.05。
HD-ZIPIII家族的系统发育分析
拟南芥中的HD-ZIPIII家族已得到很好的表征,拟南芥中HD-ZIPIII家族成员的完整氨基酸序列被用作对陆地棉国家生物信息(NBI)蛋白质数据库进行BLAST分析的查询。
系统发育分析显示棉花中有18个推定的HD-ZIPIII成员,包括8个AtREV旁系同源物、4个位于D亚基因组的基因和其他4个位于A亚基因组的基因。
此外,每个GhREV与拟南芥有超过82%的氨基酸同一性和90%的cDNA序列相似性修订版,由于A亚基因组和D亚基因组高度相似,RT-PCR无法区分GhREVsA和GhREVsD。
因此,在接下来的工作中, 我们将GhREVsA/D分别命名为GhREV1、GhREV2、GhREV3和GhREV4。
GhREVs基因的时空表达模式
基因的表达水平往往与其生物学功能相关,从子叶期和第2、4、6、8叶期的棉苗中提取根、茎、叶和茎尖的总RNA ,进行定量实时PCR(qRT-PCR)以确定GhREV的时间和空间转录表达模式。
结果显示,GhREV基因在所有测试组织中都有表达,在茎和SAM中表达较高,GhREV2和GhREV4的表达水平高于GhREV1和GhREV3在根、叶和SAM中。
而茎除了GhREV2和GhREV4之外还拥有更多的GhREV3转录本中的时间表达模式,从子叶阶段到第6叶或第8叶 阶段没有明显的差异,对于茎,我们观察到GhREV2和GhREV4的表达水平在第4叶期达到峰值, 而GhREV3在第8叶期达到峰值。
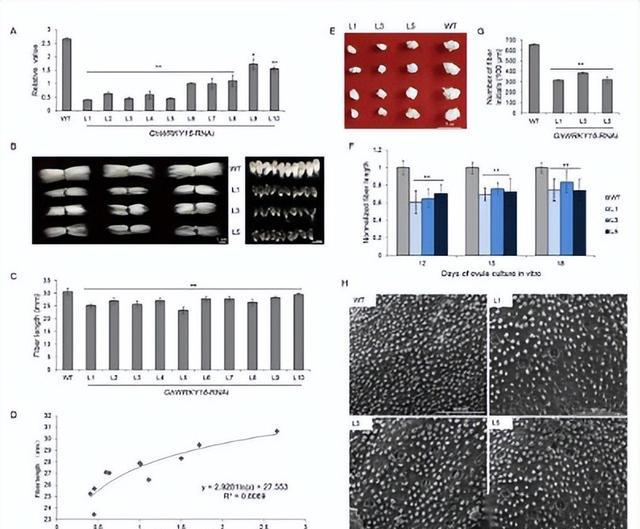
GhREV2和GhREV3作为转录激活剂
为了确定GhREV是否具有转录活性,我们进行了基于拟南芥原生质体的反式激活测定,与阴性对照相比,GhREV2和GhREV3显着激活了荧光素酶报告基因。GhREV2的激活活性与AtWRKY29相似。

GhREV2沉默导致棉花SAM发育缺陷
为了表征GhREV2的功能,我们通过基于烟草脆裂病毒(TRV)的VIGS系统在棉苗中沉默了它,植物显示白化表型后,使用qRT-PCR评估相对表达水平。

数据显示,由于GhREV基因的高度相似性,与对照相比,不仅GhREV2而且GhREV1、GhREV3和GhREV4都被沉,GhREVs的沉默效率均超过55%。
与拟南芥中的AtREV类似,GhREV在棉花的多种组织中表达,我们推测GhREV还可能参与维管束的形成、叶极性的建立以及SAM的分化,SAM中GhREV2和G hREV4的表达显着高于G hREV1和G hREV3,表明G hREV2和G hREV4可能主要在茎尖的发育中发挥作用。
此外,双荧光素酶报告基因测定显示只有GhREV2和GhREV3具有转录活性。基于时空表达模式,GhREV3可能作为茎中的正转录因子来调节维管组织的发育。
而GhREV2可能在调节SAM中发挥主要作用。尽管在所有测试组织中GhREV4的表达水平均高于GhREV1和GhREV3,但它并不充当转录激活因子,此外GhREV2位于细胞核中,正如其TF功能所预期的那样。
由于GhREVs的高度同源性,GhREV2的沉默也在一定程度上降低了其他家族成员的表达水平,然而转录活性测定表明,只有GhREV2和GhREV3具有转录活性,并且GhREV3在SAM中的表达较少,因此我们推测GhREV2在控制SAM的发育中起主要作用。

广泛的分子遗传学研究已经确定了跨物种SAM过程中起作用的关键调节因子和网络,众所周知,WUSCHEL(WUS)TF的同源结构域对于植物SAM干细胞的维持至关重要。

WUS在OC中表达,然后进入CZ并激活CLAVATA3(CLV3)的转录。反过来,CLV3可以抑制WUS表达,这些事件形成负反馈循环,保证SAM中干细胞生态位的动态大小调整。

此外,SHOOTMERISTEMLESS(STM)是KNOX家族的成员,它通过抑制CZ中器官形成因子ASYMMETRICLEAVES1 ( AS1 )和AS2的表达来防止干细胞分化,STM的突变可导致茎和分生组织提前终止。

这与WUS-CLV3途径平行,重要的是据报道,HD-ZIPIII家族,包括REV和PHB,可以与B型拟南芥反应调节器(ARR)强烈相互作用以激活WUS。

在这项研究中,发现GhWUSA10和GhSTM的表达在VIGS -GhREV2植物中被显着抑制,表明GhREV2可能与GhWUSA10和GhSTM一起发挥作用来调节棉花SAM的发育。

结论
我们在棉花中克隆了AtREV的四个直系同源基因,即GhREV1、GhREV2、GhREV3和GhREV4,所有GhREV在根、茎、叶和SAM中表达。与GhREV1和GhREV3相比, GhREV2和GhREV4在SAM中的表达水平较高。
然而,只有GhREV2具有转录活性,GhREV2定位于细胞核;通过病毒诱导基因沉默(VIGS)使其沉默,产生异常的SAM,两个关键基因, GhWUSA10和GhSTM参与调节植物SAM发育的GhREV2在VIGS -GhREV2植物中的转录本减少了约50%。
本研究的结果表明,GhREV2可能通过调节GhWUSA10和GhSTM的转录本对棉花SAM的发育产生积极影响,GhREV2通过潜在地调节GhWUSA10和GhSTM来积极调节棉花SAM的发育 。
参考文献
【1】AsaiT、TenaG、PlotnikovaJ等人。拟南芥先天免疫中的MAP激酶信号级联。自然。2002;415(6875):977。
【2】BaimaS、NobiliF、SessaG等。ATHB-8同源盒基因的表达仅限于拟南芥中的原维管细胞。发展。1995;121(12):4171-82。
【3】布斯塔曼特M、马图斯JT、里希曼JL。用于剖析茎尖分生组织中基因调控网络的全基因组分析。J实验机器人。2016;67(6):1639–49。
【4】伯恩我。芽分生组织功能和叶极性:III类HD-ZIP基因的作用。公共图书馆基因。2006;2(6):e89。
【5】GaillochetC,LohmannJU。永无止境的故事:从多能性到植物发育可塑性。发展。2015;142(13):2237–49。
