在2023年亚肝会上(第32届会议,APASL2023),研究人员介绍了正在1期临床开发阶段的乙肝在研新药ALG-125755最新临床数据。

乙肝在研新药ALG-125755,1期初步安全性结果,在亚肝会发布
该研究为GalNAc偶联小干扰RNA(siRNA)ALG-125755在健康受试者(HV)中的安全性、耐受性和药代动力学(PK)。研究人员介绍,目前慢性乙肝(CHB)的标准疗法,即核苷(酸)类似物(NA)或聚乙二醇干扰素的长期治疗,可以抑制乙肝病毒(HBV)的复制,减少大多数患者的肝脏损伤,但很少能实现功能性治愈,这是CHB治疗的目标。
在以往全球乙肝新药开发中,靶向HBV小干扰RNA(siRNA)已在慢乙肝受试者中表现出强大抗病毒活性,即降低乙肝表面抗原(HBsAg)水平。ALG-125755是一种N-乙酰半乳糖胺(GalNAc)结合的S区靶向siRNA,在非临床研究中显示出良好的安全性和强大的抗病毒活性。具体而言,ALG-125755在AAV-HBV小鼠模型中显示出显著和持久地敲除乙肝表面抗原水平潜力,并在大鼠和猴子的毒理学研究中具有良好耐受性。
本研究指ALG-125755-501研究(临床试验编号:NCT05561530),是一项由三部分组成的随机、双盲、安慰剂对照的1a/1b期研究。该研究正在对健康受试者(HV;第一部分)使用ALG-125755的单次皮下(SC)剂量以评估研究药物的安全性、耐受性、药代动力学(PK)和药效学,以及对慢乙肝受试者使用单次(第二部分)和多次(第三部分)SC剂量的ALG-125755。该研究正在进行中,且仍为盲法。
在本届亚肝会上报告的是该1期研究第一部分队列1至4的初步安全性结果,以及第一部分队列1至3的PK结果。对于第一部分中每个单次递增剂量(SAD)的队列:8名健康受试者被随机分配到ALG-125755或安慰剂,比例为3:1;在整个研究过程中,研究人员收集了安全性评估数据(包括不良事件(AEs)、生命体征、心电图(ECG)和实验室)以及血浆/尿液PK样本。
药代动力学分析方法及结果:使用经过验证的基于杂交的阴离子交换高效液相色谱法(AEX-HPLC),对20至100毫克剂量的ALG-125755和活性代谢物ALG-126144(AS(N-1)3' ALG-125755)的血浆和尿液浓度进行量化,并与荧光检测器结合。使用Phoenix WinNonLin(药动/药代分析软件)进行非室间分析来确定PK参数。
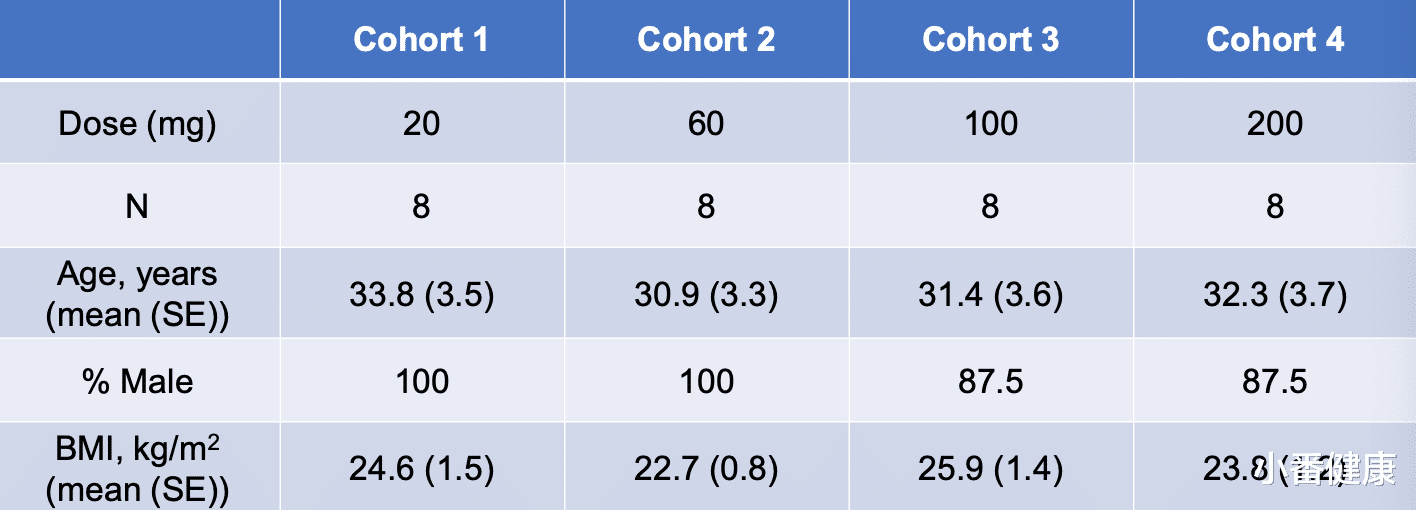
评估剂量水平方面:在4个队列中,对20、60、100和200毫克剂量单次皮下注射(SC)进行了评估。结果表明,药代动力学方面,在SC给药后,ALG-125755被迅速吸收(tmax ~3-6小时)终末血浆半衰期短(<10小时)。血浆ALG-125755暴露量与剂量成正比增加,PK变异性低(CV< 33%)。代谢物与血浆比率低(<10%)。
安全性方面:在单次皮下给药剂量高达200毫克后,没有严重的不良事件(SAE)或剂量限制性毒性。所有治疗AE(TEAE)的严重程度均为轻度(1级)。在一个以上的受试者中报告的TEAEs包括头痛(N=4)、注射部位红斑(N=2)、消化不良(N=2)和腹泻(N=2)。疼痛(N=4),注射部位红斑(N=2),消化不良(N=2),和腹泻(N=2)。

没有临床意义上的实验室异常报告;所有治疗中出现的实验室异常均为≤2级,但以下情况除外。队列1中的一名受试者有短暂的3级LDL胆固醇升高。受试者在基线时有2级LDL胆固醇升高。队列2中的一名受试者有运动相关的4级肌酸激酶和天门冬氨酸氨基转移酶3级升高。
在队列3中,有1名受试者出现短暂的3级总胆固醇升高;受试者在基线时有2级总胆固醇升高。在队列4中,有一名受试者的LDL胆固醇暂时性地达到3级。受试者在基线时有1级LDL胆固醇升高。临床体检、生命体征、心电图均无明显异常。
研究结论:在健康受试者中,使用单剂量高达200毫克的ALG-125755具有良好的耐受性。ALG-125755的暴露量按剂量比例增加,PK变异性低。预计40至100毫克剂量可以达到慢性乙肝受试者抗病毒活性所需的稳态肝脏ALG-125755的浓度。目前,正在进行第二部分,对慢乙肝受试者进行单次50毫克剂量的ALG-125755评估。
